A díjról szóló tudósítás szerint „kutatásai fókuszpontjában a sejtszintű élet-halál döntési folyamatot irányító hálózat dinamikai viselkedésének a megértése áll”.
 |
| Kapuy Orsolya |
Mi azt vizsgáljuk, hol van az a pont, és hogyan jut el a sejt addig a pontig, amikor azt „mondja”, oké, itt még fenntartom az autofágiát, megpróbálok túlélni, vagy hoppá, itt az apoptózis ideje, jöjjön a halál. Azt szeretnénk tisztázni, milyen kapcsolatok, vagy ahogy nevezzük, milyen keresztkapcsolatok vannak a két folyamat között molekuláris szinten.
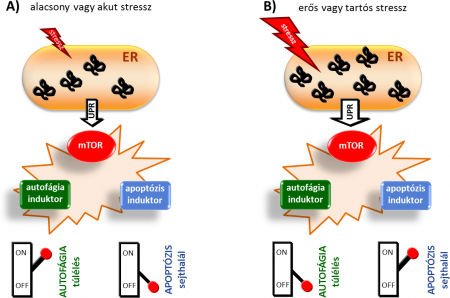
A sejtet többféle stressz érheti, például éhezés, oxidatív stressz, endoplazmás retikulum stressz, mi ezzel az utóbbival foglalkozunk. Az endoplazmás retikulum nagyon fontos sejtorganellum: különböző kiválasztó fehérjék és membránfehérjék szintézisében játszik szerepet. Ha stressz éri, számos betegség alakulhat ki (például Parkinson-kór, Alzheimer-kór).
Úgy gondoljuk, hogy ha endoplazmás retikulum stresszt idézünk elő, akkor az autofágiát és az apoptózist bekapcsoló stresszválasz-mechanizmus két folyamat, az „UPR” és az „mTOR” révén valósul meg. Az UPR-t (unfolded protein response) „nem feltekeredett fehérje válasz”-nak hívjuk. Az endoplazmás retikulumban – ahogy említettem – kiválasztó fehérjék és membránfehérjék szintetizálódnak; ha ezek nem megfelelően tekerednek fel, tehát nem megfelelően szintetizálódnak, hibás „fehérjehalom” keletkezik a sejtben. Ekkor az UPR jelátviteli útvonal kap egy jelzést, és elindítja, aktiválja az autofágiát: autofagoszómák szintetizálódnak, amelyek bekebelezik a hibás, nem megfelelően feltekeredett fehérjéket, és ezzel csökkentik a stressz hatását.
Ha még mindig termelődnek hibás fehérjék, akkor az UPR az apoptózist is aktiválja, és a sejt öngyilkosságot követ el. Más csoportokkal együtt mi is kimutattuk, hogy az apoptózis bekapcsolásakor az autofágia kikapcsol, a kettő együtt nem működik: a sejt vagy a túlélést választja, vagy a sejthalált.
Időközben észrevették, és most mi is azt vizsgáljuk, hogy az mTOR (mammalian target of rapamycin) útvonalnak milyen szerepe van ebben a keresztkapcsolatban. Eddig annyit tudtunk, hogy az mTOR a sejtek növekedésében és energiaszintjük fenntartásában játszik szerepet. Az új eredmények viszont azt mutatják, hogy ebben az élet-halál döntésben is lehet szerepe, mert az apoptózis bekapcsoláskor nagyon erős mTOR-aktivitást figyeltek meg. A keresztkapcsolatok tisztázásakor ezt mindenképpen figyelembe kell vennünk.
Milyen módszerekkel dolgoznak?
Molekuláris és elméleti biológiai megközelítést is használunk. A molekuláris biológia kísérletes eszközökkel próbálja megérteni és feltárni a szabályozási hálózatban szerepet játszó komponenseket. Nekünk humán sejtvonalaink vannak, ezeket különböző stresszorokkal kezeljük, és követjük a szabályozó molekulák fehérje- vagy RNS-szintjének a változását. Azokat a molekuláris kapcsolatokat, amelyeket kísérletesen igyekszünk feltárni, előbb matematikai modellel próbáljuk meg leírni: megjósoljuk, hogy az adott molekulák pozitívan vagy negatívan hatnak egymásra, van-e oda-vissza hatás közöttük. A matematikai modell alapján tudjuk egyáltalán elképzelni, hogy milyen szabályozási kapcsolatoknak kell kialakulniuk az élet-halál kérdés eldöntéséhez, a kísérletekben pedig megnézzük, hogy tényleg a megjósolt kapcsolatok vannak-e jelen.
Kicsit olyan, mintha puzzle-t raknánk ki: a fedőképet összerakjuk a matematikai modellel, aztán molekuláris biológiai módszerekkel megpróbáljuk a helyükre tenni a puzzle-darabokat – csakhogy ettől még nem készül el a kép, mert nem olyan, mint amilyet a játékboltban megveszünk. A fedőkép állandóan módosul, mert előfordul, hogy elsőre nem találjuk meg a megfelelő kapcsolatot, és természetesen a puzzle-darabok is változnak. A kép folyton mozog, de mégis jó kiindulási alapot teremt a munkánkhoz.
2016. április