Ezt a fehérjét – az ARHGAP25-öt – korábban még senki sem állította elő – mondja Ligeti Erzsébet professzor asszony. – Olyan fehérjecsaládba tartozik, amelynek minden egyes tagja csökkenti egy szabályozó molekula aktivitását: ez tehát sejtaktivitást csökkentő, jeltermináló fehérjecsalád. Az ide tartozó fehérjéknek van egy nem túl hosszú, nagyon hasonló központi szakaszuk, és ezzel fejtik ki a negatív (aktivitáscsökkentő) funkciót. Emellett nagyon sok más szakaszuk is van, amelyekkel más fehérjékhez kapcsolódnak; ezek a szakaszok határozzák meg, többek között, a sejtbeli elhelyezkedésüket – azt, hogy milyen molekulakomplexbe épülnek be, a sejt melyik részén, milyen környezetben fejtik ki a hatásukat.
A fehérjéknek ma már adatbázisokból kereshetjük ki a szekvenciáját, az összetételét. Mi is ezt tettük, és ebben az esetben megkönnyítette a munkánkat a központi rész hasonlósága. Megnéztük, hány ilyen fehérje lehet egyáltalán, a megtalált fehérjékről pedig további információkat szereztünk; feltártuk például, hogy milyen szövetekben fordulnak elő. Ebből a negatív regulátor-fehérjéből körülbelül hatvanféle van. Ezek nem minden sejtben fejeződnek ki, de minden sejtben a család több tagja is megjelenik, a sejt tulajdonságaitól függően.
Azt vettük észre, hogy az egyik fehérjét kódoló RNS-ből sok található az általunk vizsgált vérsejtekben – és ezt a fehérjét még soha senki nem vizsgálta. Ez a két megfigyelés további kutatásra sarkallt bennünket. Először előállítottuk a működőképes, natív fehérjét, és in vitro körülmények között elkezdtük vizsgálni a tulajdonságait. Nagy előrelépés volt, amikor sikerült ellenanyagot „gyártanunk” ellene – hiszen csak így tudtuk megnézni, hogy milyen sejtben, mekkora mennyiségben fordul elő ez a fehérje. Az antitest előállítása kemény munka, és szerencse, hogy sikerült. Azért beszélek szerencséről, mert nem minden fehérjéhez tudnak jó antitestet készíteni, akár évtizedekig is küszködhetnek ezzel a problémával.
Ezután hozzáláttunk a fehérje funkciójának felderítéséhez. A munkáról megjelent közlemény első szerzőjével, Csépányi-Kömi Rolanddal kezdetben sejtkultúrákat, izolált sejteket vizsgáltunk. Olyan sejtekben, amelyekben eredetileg nem volt jelen ez a fehérje, kifejeztük a fehérjét, olyanokban pedig, amelyekben magától kifejeződött, a „csendesítés” módszerével csökkentettük a szintjét. Közben néztük, hogy milyen funkcionális változásokat idéznek elő ezek a beavatkozások, és azt találtuk, hogy a „fehérjénk” szerepet játszik a sejtek fagocitózisának szabályozásában.
Érdekes módon egy amerikai munkacsoport, amelyik részben hasonló fehérjékkel foglalkozik, egy nagyon bonyolult, hosszú kísérletsorozat után arra a következtetésre jutott, hogy a neutrofil granulociták (a fehérvérsejtek egyik típusának) fagocitózisában három szabályozó fehérje vesz részt, és az egyik a „miénk”. Szerencsére, addigra már megjelentek a mi eredményeink a Blood című folyóiratban.
Ezután felvetődött a kérdés, hogy milyen funkcióban játszhat még szerepet ez a fehérje. A szomszédos laborban dolgozik Mocsai professzor úr kutatócsoportja. Mocsai Attila tett a legtöbbet, a legintenzívebben azért, hogy elterjessze idehaza a genetikailag módosított állatok használatát. Ő beszélt rá bennünket, hogy kezdjünk el dolgozni olyan genetikailag módosított egérrel, amelyből hiányzik ez a fehérje. Körülbelül egy év telt el, amíg a használható egérkolónia megszületett – és mi is beletanultunk a „tenyésztésbe”.
Végre elkezdhettük követni a fehérvérsejtek mozgását, és az említett cikk arról szól, milyen változásokat találtunk a mozgásukban. Kiderült, hogy a génhiányos állatokban több sejt lép ki az érfalból és gyülekezik a szövetben – ezt nevezzük gyulladásos folyamatnak –, mint egyébként. A fehérvérsejtek azonban nem mennek túl messzire. Tehát ezekben az állatokban a neutrofil granulociták nagyobb számban lépnek ki az érfalból, de aztán nem oszlanak szét a szövetben. Ez nem egészen szokványos viselkedés, ami újabb kérdéseket vet fel – ezekre szeretnénk most választ kapni.
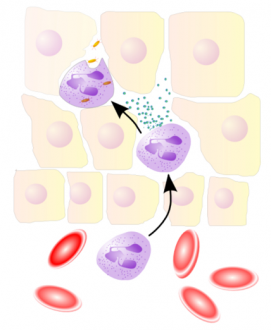 |
| A neutrofil granulocita a véredényből kilépve olyan enzimeket választ ki, amelyek „utat nyitnak” neki a sejtek között, hogy bekebelezhesse a baktériumokat |
(kép: Uwe Thormann, http://de.wikipedia.org/wiki/Benutzer:Uwe_Thormann)
A génhiányos állaton folytatott kísérletsorozatból azt láttuk, hogy ez a fehérje az állat szintjén is fontos funkciókban játszik szerepet. Mivel a hiányában nagyobb számban lépnek ki a sejtek és erőteljesebb lehet a gyulladásos reakció, azt mondjuk, hogy ha a fehérje működik a sejtben, akkor gyulladásgátló hatású. Az ilyenfajta gyulladásra – steril gyulladásról beszélünk, mert nem kórokozótól származik – sokféle terápia ismert, de nincs minden esetre megfelelő gyógyszer, ezért minden újabb lehetséges „támadáspont” hasznos lehet. Azt nem tudjuk megjósolni, hogy fejlesztenek-e majd ilyen gyógyszert, de Roland mindenképpen tovább dolgozik ezzel a fehérjével.
A fehérjét előállítottuk in vitro körülmények között is, és vizsgáljuk a szabályozását, elsősorban a foszforilációján (foszforcsoport felvételén) keresztül lejátszódó szabályozását. Ez a kutatás egy szerencsés véletlenből indult el: megkeresett bennünket egy másik amerikai munkacsoport is. Az ottani kolléga gyermek-hematológus, és az érdekelte, milyen sejtbeli változások vezetnek ahhoz, hogy a granulociták elvándoroljanak a csontvelőből és kijussanak a perifériára. Kifejlesztett egy új, tömegspektrometriás módszert, amellyel nagyon kis anyagmennyiségben vizsgálhatják a foszforilációs helyeket, és megnézték, hogy mely fehérjék foszforilációja változik a legjobban, amikor a neutrofil granulocita elhagyja a csontvelőt. Kiderült, hogy a „mi fehérjénké”. Erről a fehérjéről akkoriban csak mi írtunk még, úgyhogy megkerestek bennünket, és együttműködésre kértek fel. Az izolált fehérjénken megfelelő, célzott mutációkkal sikerült megmutatni, hogy valóban a foszforiláció befolyásolja az aktivitását. Tehát a foszforiláció szabályozhatja a működését, és úgy tűnik, ez a folyamat játszik közre abban is, hogy a neutrofil granulocita elindul a csontvelőből.
Most jelent meg a közös cikkünk a Blood című folyóiratban. Nem mi vagyunk az első szerzők, de elég fontosak vagyunk, mert mi szolgáltattuk az egyetlen közvetlen bizonyítékot arra, hogy a foszforiláció valóban szerepel a szabályozási folyamatban. Úgyhogy egy hónapon belül két cikkünk is napvilágot látott.
A motilitással, az érfalból kilépő neutrofil granulocita „vándorlásával” kapcsolatos dolgozatunkat a Journal of Immunologyban publikáltuk. Ez a lap nagyon jó színvonalú, elismert folyóirat, az Amerikai Immunológiai Társaság adja ki, de azért a Bloodnak kétszer akkora az impaktfaktora. A motilitásos cikkünk mégis bekerült a körforgalomba, mert a megjelenés hetében kiemelte a Journal of Immunology, és nekünk is mondták, hogy érdemes ismertetnünk az egyetem honlapján. Úgy gondoltam, ha Amerikában ezt javasolják, megcsináljuk – magamtól nem jutott volna eszembe. És három helyről is érkezett felkérés – átfogó cikkre, módszertani ismertetésre és a technika videóbemutatására…
De még valami meglepett. Az egyik TDK-s diákunk az egyetemi konferencián előadta a munka egy részét, egy további lépést, amely már nincs benne a cikkben. A sikeres szereplés után elküldték egy nemzetközi TDK-konferenciára, ahol szintén díjat nyert, és ezek után egy folyóirat e-mailben felkérte, hogy küldje el az előadás írott változatát. Ezen még dolgoznunk kell, mindenesetre elcsodálkoztam azon, hogy bizonyos folyóiratok mennyire figyelnek. Még egy nemzetközi diákkonferencia anyagát is végignézik, és már a születés pillanatában „lecsapnak” az eredményekre.
Ugyanakkor egy rangos folyóirat megköveteli, hogy minden lehetséges bizonyítási lehetőséget felhasználjunk – akkor is, ha ezek lényegében semmit sem adnak hozzá az eredményhez. De miután ezt kérik, meg kell csinálnunk – és megy vele az idő. A Journal of Immunology, kivételesen, kilenc hónapot ad a módosításra, de majdnem hét hónapot el is dolgoztunk a kiegészítésen, mert olyan új kísérleteket kívántak meg, amilyeneket azelőtt sose csináltunk. Komplikáltabb lett a kutatás, a publikálás – és több időt igényel.
Nálunk kevesebben dolgoznak egy témán, mint például egy jó nyugat-európai műhelyben.
Igen, de ezt nem gondolom hátránynak, éppen ellenkezőleg. Nyugat-Európában nagy laborban dolgoztam. Csodálatos volt vendégként kutatni, és hívtak ugyan, de nem maradtam ott: túl nagy volt a forgalom, túl kevés az elmélyült gondolkodás. A kicsit kisebb, beláthatóbb struktúrákban sokkal jobban érzem magam, és produktívabb vagyok.
Fontos az anyagi-tárgyi lehetőség, a nagy munkacsoport, de a szellemi háttér és az érzelmi viszonyulás legalább olyan fontos, s ez jobban inspirál időnként. Ér annyit, mint egy nagyműszer. Ma már kevés az olyan nagyműszer, amely nem érhető el Magyarországon. Nem mondhatom, hogy nagyon akadályozna bennünket a műszerhiány. De ha többen lennénk, jobban megoszlana az oktatás, és mindenkinek több ideje jutna a kutatásra. Az idő hiányzik a legjobban.
A másik támogatott projektben – ahogy korábban fogalmazott – „a sejtek közötti hírközlés eddig ismeretlen mechanizmusá”-nak feltárásán dolgoznak.
Ez hihetetlenül izgalmas fejlemény. Most már tudjuk, hogy minden sejt kis vezikulumokat – különböző méretű golyóbisokat – választ ki. A vezikulumok foszfolipid membránnal körülvett képződmények; fehérjék, nukleinsavak, citoplazmatikus anyagok is vannak bennük, és nagyon fontos szerepet töltenek be a sejtek közötti információátvitelben. Ez a kutatási terület az elmúlt tíz évben óriásit fejlődött; csak öt évvel ezelőtt rendezték az első nagy nemzetközi konferenciát.
Az elsők között mutattunk rá arra, hogy ugyanaz a sejt különböző stimulusokra eltérő típusú vezikulumokat gyárthat. Ami a legérdekesebb: a neutrofil granulocita bizonyos stimulálásra olyan vezikulát képez, amelyek megkötik a baktériumokat, és gátolják a növekedésüket. Tehát a neutrofil nemcsak az ismert módon kebelezi be és pusztítja el a baktériumokat, hanem még ilyen részecskéket is kilő magából. Sőt, a granulocita akkor is tud „távhatású” bombákat küldeni, ha letapad valahova. Azóta sokfajta sejtről kimutatták, hogy eltérő összetételű vezikulumokat képes létrehozni, ezért ez valószínűleg általánosabb tulajdonság, mint sejtettük, csak más sejtfajta esetében még nem láttam, hogy szisztematikusan kimutatnák: milyen inger és milyen receptoron keresztülmenő inger vezet az eltérő vezikula kialakításához. Mi most azon dolgozunk, hogy ezeket a granulocitán levő receptorokat és annak a szignalizációs útnak a kezdetét leírjuk, amely antibakteriális vezikula keletkezéséhez vezet. Részben emberi vérből származó granulocitákat, részben pedig Mocsai professzor sokféle génhiányos állatának granulocitáit vizsgáljuk; a humán és az egéradatok szépen illeszkednek egymáshoz.
A kérdés egyik oldala tehát, hogy hogyan keletkezik az antibakteriális vezikulum, a másik pedig, hogy milyen tulajdonságok teszik antibakteriálissá, és milyen felszíni képződményeken, struktúrákon keresztül fogja meg a baktériumot. A baktériumkötő tulajdonság a citoszkeletontól, a citoszkeleton állapotától függ, de még nem látom a folyamat hátterét. Van egy harmadik problémakör is: a neutrofilból származó, különböző típusú vezikulumok hogyan hatnak vissza a neutrofilra, és hogyan hatnak azokra a sejtekre, például az endotél sejtekre, amelyekkel kapcsolatba kerülhetnek. Végül pedig azt is vizsgáljuk, hogyan működnek ezek a folyamatok a patológiás állapotokban: olyan, kritikus állapotban levő betegekben próbáljuk nyomon követni a lépéseket, akik bakteriális fertőzésben, szepszisben szenvednek, és olyanokban, akik hasonlóan kritikus állapotban vannak, de nem bakteriális, hanem más, például kardiogén eredetű probléma miatt. A szepszis vizsgálatában most már jó néhány éve együttműködünk az Aneszteziológiai Klinikával, és nemrégiben megkeresett bennünket a Kardiológiai Klinika is. Mindkét közös kutatásban a neutrofil granulociták teljes – a korábban ismert és a vezikulumos – működését vizsgáljuk. A PhD-hallgatóink közül többen klinikai érdeklődésűek, járnak is ügyelni klinikai közegbe: ezek a személyes kapcsolatok nagyon segítik az együttműködést, a minták gyűjtését.
A klinikai együttműködés a megértést szolgálja, vagy közelebb visz esetleg a gyógyításhoz?
Elsősorban a jelenség mélyére akarunk látni, de lehet, hogy a gyógyításhoz is eljutunk. A kardiológus kollégák például azt a kérdést tették fel, hogy találunk-e olyan markáns különbséget, amely a korai szakaszban segít nekik bizonyos döntések meghozatalában. Tehát meg kell vizsgálnunk, hogy a neutrofil granulocita működésében van-e olyan korán detektálható változás, amiből bármifajta további terápiás következtetést lehet levonni. A szepszis esetében eljutottunk egy izgalmas megfigyeléshez, amely terápiás következményekkel is járhat.
2016. december






