Pályázataiban kiemelte, hogy az antibiotikumok körébe tartozó peptid-antibiotikumok egy csoportjában és az Alzheimer-kórhoz kapcsolt amiloid szálak kialakulásakor hasonló szerkezetű egységek jelenhetnek meg.
 |
| Beke-Somfai Tamás |
Az antimikrobiális peptidek – amelyeket a gazdaszervezet, például az emberi szervezet is kifejleszthet a mikrobák ellen – úgy „mérgeznek” egy baktériumot, hogy például megkötik, gátolják az egyik enzimjét (így működik a penicillin), de a nagyobbak egymással önrendeződve hordószerű lyukat is vághatnak a baktérium membránjain. Ezzel fiziológiai egyensúlyokat rúgnak fel: a lyukon át kismolekulák járkálhatnak ki-be, és végül a baktérium elpusztul, mert „kifolyik” a belseje.
Ha sikerülne olyan modellrendszereket „belőnünk”, amelyeken ezeket az elsősorban hordóba rendeződő peptidszerkezeteket tanulmányozhatnánk, akkor nagyot lépnénk előre mind az amiloid oligomerek kialakulásának megértésében és ezzel a gátlásában, mind az antimikrobiális hatású peptidek önrendeződési tulajdonságainak a megértésében.
Gondolom, a munkájuk számításokon alapulna.
Jóval korábban nem természetes alapú peptideket vizsgáltam számítógépes módszerekkel. Miközben a kísérletes emberek is több tanulmányban bemutatták, hogy ezek a rendszerek hajlamosak az önrendeződésre, észrevettem, hogy a nem természetes aminosavakból álló, béta-peptidek ugyanolyan típusú hordók alkotására képesek, mint egyes, természetes aminosavakból álló peptidek.
Mi a különbség a kétféle peptid között?
Az alfa-aminosavak nagy számban megtalálhatók a természetben; a béta-aminosavak összekapcsolódásakor egy metiléncsoport is belekerül a peptid gerincébe, amitől megváltoznak a szerkezeti tulajdonságok. Ezt 2006-ban találtam elméleti módszerekkel a Perczel András vezette csoportban, szenior kutatóként; 2006-ban és 2008-ban publikáltuk.
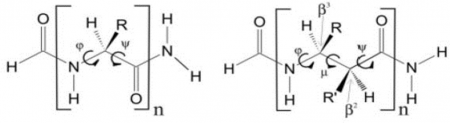 |
| Balra: Alfa-aminosavak, jobbra: béta-aminosavak szerkezeti alegységei |
A nem természetes alapú – foldamer – peptidek kutatása akkoriban bontakozott ki. Itt szeretném megemlíteni, hogy az enyémnél sokkal magasabb, kísérleti szinten többen űzik ezt a mesterséget, például Szegeden Fülöp Ferenc, Mándity István és Martinek Tamás csoportja. A kísérleti csoportok sokféle foldamert állítottak elő, mert ezek korábban nem szerepeltek a palettán, és érdekesnek találták őket. Számunkra és a kémiai közösség számára is az volt az igazi meglepetés, hogy a természetes aminosavakból felépülő peptidekhez hasonlóan a nem természetes aminosavakból felépülő peptidek is alkothatnak változatos másodlagos szerkezeti elemeket – például hélixet, béta-redőt –, és ha ezek egymás mellé rendeződnek, fehérje-térszerkezet alakul ki.
Fölvetődhet a kérdés, hogy miért hagyta ki a természet ezeket a peptideket. Több mint fél évszázada Stanley Miller nagyon híres kísérletben szimulálta az élet kialakulása előtti földi állapotokat: nagy kisüléseket (villámokat) adott egyszerű molekulák – metán, ammónia, hidrogén, vízgőz –keverékére, és talált egy csomó olyan molekulát, amely az élő szervezetekben is megjelenik. A lehűtött „levesben” béta-aminosav is volt. Később üstökösökben is kimutattak béta-aminosavakat.
Valószínűleg azért van belőlük kevés az élő szervezetben, mert túl flexibilisek. Emiatt a mozgékonyság miatt, érdekes módon, nem sokféle, hanem csak egyetlen szerkezetet vesznek fel. A természetes aminosav csak két „torziós szöge” mentén foroghat – és azért forog, hogy a részlegesen pozitív csoportokat hozzárendelje a részelegesen negatív csoportokhoz. A béta-aminosav viszont, a három torziós szög miatt, rögtön egymáshoz tudja rendezni a pozitív és a negatív töltést, ami a legerősebb kölcsönhatást adja, ezért vesz fel mindig egyetlen szerkezetet.
De vannak praktikusabb kérdések is. A gazdasejtben a lebontó enzimek „megeszik” a mérgező molekulákat, mondjuk, a természetes alapú antimikrobiális peptideket, így ezek hatékonysága erősen csökken. Mivel a béta-peptidek gerincén metiléncsoportok is megjelennek, a peptidek megnyúlnak, nem tudnak bekötődni a gazdasejt „kötőzsebébe”, külső üregeibe, ahol az enzimek megtámadhatnák őket, másként fogalmazva: ellenállnak a lebontó enzimeknek.
Emiatt szerepelnek béta-peptidek a mostani kutatásukban?
Egyelőre nem az a célunk, hogy béta-peptideket vizsgáljunk, mert ezek antimikrobiális tulajdonságait már hat-nyolc éve elkezdték tanulmányozni – a miénknél sokkal nagyon apparátussal rendelkező kutatói társulások –, de mind a mai napig nem értjük, milyen mechanizmussal hatnak kölcsön ezek a molekulák a lipid kettősréteggel, a membránnal, és hogyan tudunk racionálisan, tudatosan tervezni olyan molekulákat, amelyek mindig ugyanezt a mechanizmust használják. Ezt sem a természetes, sem a nem természetes antimikrobiális peptidek esetében nem értjük, ezért szeretnénk tisztázni.
Miután foglalkoztam egy ideig ezekkel a nem természetes peptidekkel, elmentem néhány évre Svédországba, és ott a számítógépes munka mellett számos lipid kettősréteggel vagy lipid rendszerrel (a membránok egyszerű modelljeivel) kísérletezhettem. Azt vettem észre, hogy a kísérleti emberek nemigen próbálnak meg béta-peptideket bevinni a lipid kettősrétegbe, ezért senki sem nézte meg – amit mi 2006–2008-ban számításokkal kimutattunk –, hogy ezek mennyire kompakt hordószerkezeteket alkothatnának. Mivel a peptides-számítógépes tudásom kiegészült a kísérletes „lipidtudással”, érdemesnek tűnik körüljárnom ezt a problémát.
Az önéletrajzában megemlíti, hogy a Molecular Frontiers Foundation önkéntese. Mi tudhatunk erről a szervezetről?
A svédországi mentorom, Bengt Nordén hozta létre részben azért, hogy a gyerekek kiváló kutatókkal, Nobel-díjasokkal vagy az MIT-n, a Harvardon dolgozó kutatókkal találkozhassanak, és ezzel inspirálja őket a kutatói pályára.
Szeretnénk, ha az egyik találkozó Budapesten lenne, és már el is kezdtük szervezni. Még nem tudjuk hivatalosan bejelenteni, de úgy tűnik, 2017 októberére sikerül egy Molecular Frontiers-szimpóziumot Magyarországra hoznunk. Ilyenkor két-három nap alatt tíz-tizenkét nagyon neves kutatóval találkozhatnak a – rendszerint középiskolás – gyerekek, és persze a felnőtt szakmabeliek sem hagynak ki egy ilyen alkalmat. Bengt Nordén „mindenkit ismer”, hiszen nagyon sokáig a kémiai Nobel-bizottság tagja volt.
Miért jöttek haza, vagy miért haza jöttek Svédországból?
Világos volt, hogy nem fogok ott megállapodni. Én jól érzem magam Magyarországon, sokkal jobb ország, mint ahogy sokan gondolják.
2016. május






