 |
| Dénes Ádám |
A kutatási programunkban nagyon sok érdekes eredmény született: kiderült például, hogy az agyi gyulladásos folyamatok fontosak az agyi sérülések és az agyi betegségek kialakulásában. Meglepő módon, sok esetben először az agyon kívül kezdődnek a később károsodást okozó gyulladásos folyamatok (szisztémás gyulladásos folyamatok), és az elmúlt időszakban az is világossá vált, hogy ezek rendkívül nagy szerepet játszanak az agyi gyulladás és a különböző idegrendszeri betegségek létrejöttében is.
A kísérleteink és mások kísérletei alapján az a nézőpont alakult ki, hogy a gyulladásos folyamatok legalább két módon vesznek részt az idegrendszeri betegségek kialakulásában. Egyrészt a társadalom széles rétegeiben előforduló betegségekről (pl. cukorbetegség, érelmeszesedés, elhízás, magas vérnyomás) megtudtuk, hogy komoly krónikus gyulladásos betegségek – előfordulásuk esetén emelkedett gyulladásos állapot mutatható ki a szervezet több részében, melynek eredményeként például megnő a keringésben a gyulladásos faktorok szintje. Ezek a betegségek, érdekes módon, sokféle idegrendszeri betegség kialakulására hajlamosítanak például a stroke-ra és a neurodegeneratív betegségekre, köztük az Alzheimer- és a Parkinson-kórra. A gyulladásos folyamatok hatását még a depresszióban és különféle mentális zavarokban is kimutatták.
Másrészt akkor, amikor akut esemény jelentkezik az agyban, legyen az stroke, epilepsziás roham vagy baleset következtében fellépő agyi trauma, hirtelen az agyszövetben is gyulladásos folyamatok indulnak el. Kiderült, hogy az ilyenkor felszabaduló gyulladásos faktorok aktívan közre is működnek az agyi sérülés kialakulásában, mert ha gátoljuk a termelődésüket (elsősorban kísérletes modellekben, de most már humán esetekről is vannak adataink), akkor az agyi sérülés egy részét vissza lehet fordítani: csökkenteni lehet a károsodást.
Ha az evolúció felől közelítjük meg az agyi betegségek kialakulását, akkor azt mondhatjuk, hogy a nagyméretű agyi sérülés és az idős élőlények nemigen fejtenek ki olyan szelekciós hatást, ami miatt ezek a mechanizmusok kiszelektálódhattak volna. A kisebb agyi sérülések, fertőzések, illetve az agy normális fejlődése során viszont van szerepük a különböző gyulladásos folyamatoknak. Tehát azzal, hogy a modern ember tovább él, olyan halálos kombinációknak tette ki magát, amelyek régen nem fordultak elő vagy nem volt jelentőségük – hiszen az emberek korán meghaltak vagy ritkán éltek túl ilyen eseményeket.
Az agyban a gyulladásos folyamatok legfontosabb szabályozói a mikroglia sejtek. Ezek zömmel a perifériás keringéstől elzárt területeken vannak, ezért korábban nehezen tudtuk eltávolítani őket, és működésük szelektív befolyásolása is akadályokba ütközött. Emiatt nem is lehetett tisztázni, milyen szerepet játszanak az agyi sérülésekben. De történt egy lényeges változás. Az NKFI-projekt elindulása idején születtek meg azok a módszereink, amelyekkel szelektíven „hozzá tudtunk nyúlni” a mikroglia sejtekhez, és megvizsgálhattuk, hogyan viselkednek az agyi sérülések, például a stroke esetén.
Ennek a kutatási sorozatnak a részeként nagy felbontású képalkotó módszerekkel – kétfoton-mikroszkópiával, szuperrezolúciós mikroszkópiával – nyomon követhettük például, hogyan változik meg az idegsejtek aktivitása és sok molekuláris folyamata egy sérült agyban, és mi történik az agyban stroke esetén, ha jelen vannak a mikroglia sejtek, illetve ha eltávolítjuk őket. A nagy felbontású, kétfoton-mikroszkópiás vizsgálatokban Rózsa Balázsékkal (MTA KOKI) dolgoztunk együtt, az általuk kifejlesztett képalkotó eljárások nélkül nem vizsgálhattuk volna az idegsejtek aktivitását az élő agyban.
Hogyan lehet egyféle sejtet kivenni?
Több olyan gyógyszergyárral is régóta kapcsolatban állok, amelyek a mikroglia különböző folyamatait szerették volna korábban gátolni. A mikroglia sejtek gyulladásos faktorokat tudnak termelni, és sok agyi betegségben (emberi agyszövetben is) kimutatták, hogy a mikroglia sejtek minden elváltozás esetén nagyon hamar aktiválódnak. A kérdés a következő volt: ez az aktiváció annak az eredménye, hogy az agyban valami nem működik jól, vagy éppen fordítva, az agyi károsodás kialakulásában játszik szerepet?
Az egyik gyógyszergyárban fejlesztettek egy olyan anyagot, amellyel szelektíven gátolható a mikroglia egyik életfontosságú útvonala, és ez a felnőtt szervezetben egyéb típusú sejtek számára megkerülhetőnek tűnik. Ennek részben az lehet az oka, hogy a mikroglia sejtek speciális populációt képviselnek; az embrionális fejlődés során nagyon korán bekerülnek az agyba, és ott önfenntartóan működnek. Úgy tűnik tehát, hogy ezzel az anyaggal szabályozhatjuk a mikroglia sejtek túlélését. A kezelés más érdemi hatását nem látjuk a szervezet egyéb részeiben, ami persze nem zárja ki ezt a lehetőséget.
Ezek szerint a mikroglia sejtet nem veszik ki, hanem gátolják.
Igen, de pár hetes kezelés után szelektíven el is tudjuk pusztítani, ezért olyan agyat is „elő tudunk állítani”, amelyből hiányzik a mikroglia sejtek 98 százaléka.
Így már meg tudtuk nézni, mi történik az agyban, ha hiányzik a mikroglia egy agyi sérülés idején. Mivel a gyulladásos faktorok fontosak az agyi sérülések kialakulásában, mindenki azt várta, hogy ha kivesszük azt a fő sejttípust, amely a gyulladásos faktorokat termeli, jobb lesz a sérülés kimenetele.
Ennek éppen az ellenkezőjét láttuk: a mikroglia sejtek eltávolítása nagymértékben megnövelte az agyi károsodást, és az agyi sérülést követően teljesen átrendezte az idegsejtek aktivitását. Ebből nagyon sok következtetést le lehet vonni – az egyik legfontosabb az, hogy a mikroglia sejtek okkal vannak a helyükön. Érdemes lenne szeletív módon gátolni azokat a gyulladásos folyamataikat, amelyek károsak, és ezzel csökkenthetnénk az agyi károsodás mértékét, de alapvetően szükség van rájuk.
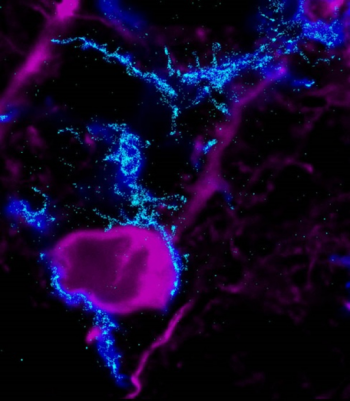 |
| Mikroglia-idegsejt interakciók az agyban (Orsolits Barbara felvétele) |
Meg kellene tehát értenünk a mikroglia sejtek működését, az idegsejtekkel kialakított kölcsönhatását. Mivel a kísérletek alapján támogató működést tételezünk fel, ezt gyógyszeresen is érdemes lenne serkenteni. Azért is fontos ennek a kérdésnek a tisztázása, mert az elmúlt 20–25 évben borzasztó sok klinikai próba bukott el a legkülönfélébb idegrendszeri betegségek, különösen a stroke esetében. Körülbelül 1200 olyan idegrendszert védő anyagot ismerünk, amely jól működött a kísérletes modellekben. A humán vizsgálatok során több mint 300-at teszteltek közülük, és kivétel nélkül mindegyik megbukott. Ez nagy negatív hatást gyakorol az idegrendszeri betegségek kutatási területére, mert megnehezíti az együttműködést a gyógyszergyárakkal, a kutatást támogató szervezetekkel. Nagyon sokat vitatkoztunk arról, hogy miért végződtek kudarccal ezek a kísérletek. Mindig azt mondtam, hogy nem értjük jól az agyi sérülés, és ezen belül a gyulladásos folyamatok mechanizmusait, és hiába próbálunk megvédeni egy idegsejtet, ha nem tudjuk megvédeni az őt ellátó keringést, vagy az őt támogató agyi sejteket, például a mikroglia, az asztroglia vagy az oligodendroglia sejteket. Amíg nem értjük meg a folyamatokat, nehéz olyan terápiás eljárásokat fejleszteni, amelyek szelektíven támadják az idegsejtek károsodását fokozó útvonalakat, és esetleg serkentik a védő funkciót kifejtő útvonalakat.
Hadd mondjak egy hasonlatot: előfordul, hogy valaki beugrik a Balatonba, belefejel a fövenybe, elsüllyed és megfullad, nem lehet megmenteni. A víz alá süllyedt korcsolyázókat sokszor húsz perc elteltével is újra lehet éleszteni. Ők is megfulladnak, csak a rendkívül hideg víz „hibernálja” az élettani folyamatokat, ezért ha nem történt visszafordíthatatlan károsodás az agyban, a szív- és érrendszerben, más létfontosságú területeken, újraélesztés után jelentősen csökkenthető az agykárosodás, és az illető akár maradandó tünetek nélkül is megúszhatja.
Amióta az idegrendszeri betegségeket tanulmányozzuk, folyton azt hangoztatjuk, hogy az akut agyi sérülések után valahogyan el kellene elérnünk az idegsejtek elhalásának késleltetését. Így időt nyernénk ahhoz, hogy például egy stroke után visszaállítsuk az agyi keringést. Meg kell tehát értenünk a mechanizmusokat. Azt nem feltétlenül várhatjuk el, hogy a sérült idegsejteket meg tudjuk védeni gyógyszerekkel, ha nem működik normálisan az agyi keringés. Ez más típusú gondolkodás, mint a korábbi, amikor idegsejteket védő anyagok beadásával próbálkoztak. Pontosabban akkor is rengeteg mechanizmust feltártak az állatkísérletekben, de ezek közül nagyon sok nem működött a klinikumban. Ennek valószínűleg az az oka, hogy nem modellezhették jól ezeket a betegségeket az állatokban, nem értették meg jól a mechanizmusokat, és talán a klinikai vizsgálatokat sem végezték el jól. Erre több adat utal; sokszor olyan időintervallumban folyt a kezelés, amikor – a mai tudásunk fényében – szinte bármilyen szerrel biztosan negatív lenne az eredmény.
A krónikus betegségek körében pedig az okozza a legnagyobb problémát, hogy amikorra egy beteg kimutathatóan Alzheimer- vagy Parkinson-kóros, már olyan fokú idegi károsodás ment végbe, hogy sok folyamatot lehetetlen visszafordítani. Az állapotromlást lassíthatjuk vagy talán teljesen gátolhatjuk, de az alapállapot nem áll már tökéletesen helyre, hiszen a felnőtt agyban nagyon nehezen pótolhatók az idegsejtek.
A krónikus vagy degeneratív betegségek esetében nagyon korán kellene érzékelnünk a baj készülődését, és akkor kellene elkezdenünk a betegek kezelését, amikor az idegsejtek zöme még nem károsodott annyira, hogy a folyamat visszafordíthatatlanná váljon.
Ehhez nyilván ki kellene szűrni a veszélyeztetett embereket.
Az utóbbi időben sok okos ötlet felmerült, ilyen például a biomarker-kutatás: különböző betegségcsoportok esetén egyes biológiai folyamatok jelzőmolekuláit például a vérben próbálják meg kimutatni, hogy előre kiderüljön egy készülődő betegség. Ez jó diagnosztikai eszköz lehet, ha elég olcsó és nagy populációkban használható. A stroke esetében mi is folytattunk ilyen kutatásokat: azokban a betegekben, akik még nem kaptak stroke-ot, de nagy volt ennek a kockázata, a gyulladásos faktorok emelkedett szintje mutatta, hogy az agyban már ott van a gyulladás. A betegek egy része, a vizsgálatok után, valóban stroke-os lett – ami nagyon paradox módon igazolja, hogy érdemes követnünk ezeket a folyamatokat.
Hogyan dolgoznak?
Elsősorban kísérletes modelleket használunk, ezek egy része állatkísérlet. Gyakran altatott állatok élő, intakt agyát vizsgáljuk képalkotó módszerekkel, és közben kísérletes stroke-ot vagy gyulladásos folyamatokat idézünk elő. Máskor olyan genetikailag módosított egereket használunk, amelyeknek a szokásostól eltérő módon működnek a mikroglia sejtjei, vagy a gyulladásos folyamataikat szabályozzuk szelektíven, és megnézzük, hogyan hatnak ezek a folyamatok az agyi sérülésre mesterségesen előidézett agyi betegségek, például stroke vagy neurodegeneratív kondíciók esetén.
Az in vitro vizsgálatokban az agyból kivett sejteket tenyésztjük sejtkultúrákban. Ezek a rendszerek sokszor hasznosak az alapvető folyamatok mechanizmusainak megértésében. Például megnézhetjük, milyen gyulladásos faktorok aktiválnak bizonyos típusú agyi sejteket, vagy milyen faktorok szükségesek a mikroglia sejtek túléléséhez, és hogyan lehet ezeket szelektíven befolyásolni. Ha valami érdekeset találunk egy sejtkultúrában, akkor továbblépünk az állatkísérletekhez.
A kutatásainknak van egy harmadik „karja”: sok post-mortem humán szövetet is vizsgálunk. Az agyi betegségben elhalálozott betegek agyszöveteiben olyan festéseket alkalmazunk, amelyekből következtetni lehet az agyban lezajlott gyulladásos folyamatokra, és ezt a képet megpróbáljuk összehasonlítani a kísérleti modelljeinkben látottakkal, sőt, azt is megnézhetjük, hogy a betegségek kialakulása előtt vagy alatt megjelenő gyulladásos faktorok korreláltathatók-e az agyi sérülés mértékével. Ezek részben már klinikai vizsgálatok.
Jó modellek az in vitro tenyészetek? Érik esetleg meglepetések, amikor áttérnek az élő szervezetre?
Előfordul. Az in vitro modellek nem helyettesíthetik az élő szervezetben nyert adatokat, és azokat sem, amelyek a klinikai kutatásokból kerülnek elő, de nagyon hasznosak az alapvető mechanizmusok megértése szempontjából. Természetesen mindig kritikusan kell tesztelnünk az in vitro modellekből szerzett következtetéseket. Viszont ha egy sejttípus esetén 300 különböző anyagot szeretnék tesztelni, mert tudni akarom, hogy lehet-e befolyásolni ennek a sejttípusnak az aktivitását, és tudni akarom, hogy lehet-e ezekből az anyagokból gyógyszermolekula, akkor in vitro kísérletekkel kell kezdenünk, és csak az ígéretesnek tűnő molekulákat tesztelhetjük az állatkísérletekben (ahonnan még hosszú út vezet a klinikai vizsgálatokig).
Nagyon jó körülmények között dolgozott Manchesterben, az utolsó évben külön díjazták a kutatásait: miért döntött a hazatérés mellett?
Sokféle válasz lehetséges, mondhatom azt is, hogy kalandvágyból. De inkább idézném Terentiust, aki szerint csak égboltot vált, nem lelket, aki áthajózik a tengeren. Hozzá kell tenni, hogy az elmúlt időszakban Magyarországon megindult egy folyamat – nemcsak az idegtudományban –, hogy új forrásokkal segítsék a kutatók itthon maradását, megpróbálják megteremteni a hazai kutatások financiális hátterét. Ilyen a Lendület-program, az idegtudománynak nagyon komoly forrásokat adott a Nemzeti Agykutatási Program és természetesen itt vannak az NFKI-pályázatok. Ez, persze, még nem old meg mindent, sokkal több pénzre lenne szükség, amit strukturáltabban, szervezettebben kellene elosztani a hazai alapkutatásban. De az én korosztályom megszokta, hogy utazik, és már nem hajlandó annyira félni. A hazaérkezés tehát pozitív élmény volt. Amíg az embert nem érik perdöntő negatív tapasztalatok, fenn tudja tartani a kutatásait, addig megpróbál itthon maradni. A kérdés az, hogy ki milyen státuszt tölt be nemzetközi szinten a saját kutatási területén. Nyilván ez meghatározza a lehetőségeit és azt a szintet is, amit hajlandó tolerálni.
A mostani szellemi elit zöme már járt külföldön, és talán azt is látta, hogyan működtetik máshol a tudománypolitikát, mit érdemes ebből itthon megvalósítani, vagy a jól működő dolgokból megőrizni. De csak akkor képes előrevinni az ország dolgait, ha szakmai alapokra helyezett véleménye itthon is meghallgatásra talál. Ezért fontos a megfelelő párbeszéd kialakulása a tudomány, az egészségügyi ellátórendszerek és a politika között. Ez nagy kihívás.
2016. június






