A nagyszerű eredmény abban a konzorciális NKFI-projektben született, amelyet Pál Gábor és Gál Péter irányít1. Szeptember elején Pál Gábor, az ELTE Biokémiai Tanszékén működő Irányított Fehérje-evolúció Kutatócsoport vezetője igyekezett közérthetően megvilágítani számunkra a kutatás tudományos lényegét, jelentőségét:
Számos mikroba ártalmatlan, sőt fontos lakótárs az emberi szervezetben, míg más mikrobák úgy próbálnak meg hasznot húzni az együttélésből, hogy eközben komoly betegségeket is okozhatnak. A kordában tartott együttélésre fejlődött ki az evolúció során az ősibb veleszületett, majd az evolúciósan fiatalabb adaptív, alkalmazkodó immunrendszer. A veleszületett immunrendszer fehérjéinek génjei egész életünkben olyanok maradnak, mint amilyenek a fogantatásunk pillanatában voltak. Az adaptív immunrendszer génjei ezzel szemben az életünk során folyamatos átalakulásban vannak, és hatalmas variáns-sereget állítanak elő olyan fehérjékből (ellenanyagok és T-sejt receptorok), amelyek felismerik és csapdába ejtik a mikrobákat és más káros objektumokat (például meghibásodott sejtjeinket). A sikeresnek bizonyuló fehérjék génjeit hordozó immunsejtek (B- és T-sejtek) elszaporodnak, és a jövőre nézve is védelmet biztosítanak.
A komplementrendszer az ősibb, veleszületett immunrendszer része: ennek elemeit „készen kapjuk”. Működésében nem vesznek közvetlenül részt sejtek: a rendszeren belül minden feladat fehérjékre hárul – ezek védenek bennünket a betolakodóktól. Harminc-negyven fehérjét sorolnak a komplementrendszer fehérjehálózatába. Nemcsak azért nem mondunk pontos számot, mert még nem ismerünk minden ilyen fehérjét, hanem mert a komplementrendszer – sok más fogalommal együtt – csak a mi modellünk egy jelenség megértésére, a rendszer határai nem élesek, adott esetben egy-egy fehérje egyszerre több „rendszerben” is szerepet játszhat.
A fehérjék makromolekulák, amelyeknek nagyon érdekes tulajdonságaik vannak: rettentő pontosan választhatják ki a partnerüket – szelektíven, specifikusan kötődnek egymáshoz –, és több tízezer fajta fehérjéből adott esetben csak néhány fajtával képesek hosszabb időre összetapadni. A fehérjék egy része más fehérjék láncát elhasítani képes enzim, idegen szóval proteáz. A klasszikus táplálékemésztő proteáz enzimek (tripszin, kimotripszin) praktikusan minden fehérjét képesek számos helyen elhasítani. Az erősen szabályozott rendszerek, például a véralvadás és a komplementrendszer proteázai azonban tipikusan csak egy-két fehérjéhez tudnak stabilan hozzákötni, és azoknak is csak egyetlen kijelölt pontján hasítják el a láncot.
Így „bánik el” a komplementrendszer a kórokozókkal is?
Nem, a komplementrendszer proteázai nem „eszik meg” így a behatolót, ennél sokkal kifinomultabb módon működik ez a rendszer. Mint látni fogjuk, a komplementrendszer proteázainak egyik funkciója az, hogy megjelöljék a behatolót a fagocitáló immunsejtek számára. Ezek bekebelezik a kórokozó sejtet, és proteázaikkal valóban aminosavakra cincálják.
A komplementrendszer védekezésére három fő útvonal (klasszikus, lektin- és alternatív út) szolgál, amelyek egy ponton egyesülnek. A betolakodót a komplementrendszer receptorszerű fehérjéi ismerik fel. A lektin-út receptorai ősi molekuláris mintázatokat ismernek fel a betolakodón. A klasszikus út receptora elsősorban azt ismeri fel, hogy a betolakodó már ellenanyagokkal van borítva (amelyek az adaptív immunrendszer válasza során rakódnak rá). A komplementrendszer-proteázok egy része ezeken a receptorokon „utazik”, eleinte „alvó” állapotban. A felismerés receptoron belüli kis elmozdulásokkal jár, amit a proteázok érzékelnek, „félálomba” kerülve nagyon precízen behasogatnak egymásba, amitől teljesen „éber” állapotba kerülnek, maximálisan aktívvá válnak. Minden aktív proteázmolekula számos másikat ébreszt fel: elképesztő gyorsan elterjed a betolakodó felismerésének híre, amire lavinaszerűen fokozódó ellenválasz alakul ki.
A vérben rendkívül nagy mennyiségben keringenek olyan komplementfehérjék (ilyen a C4 és a C3 nevű fehérje), amelyeknek – amíg nem kerül betolakodó a szervezetbe – nincs látható funkciójuk. Amint azonban egy betolakodó sejt felszínén aktiválódnak a komplementproteázok, olyan proteázok is felébresztődnek, amelyek elhasítják a C4, illetve a C3 fehérjéket. A hasított C4 és C3 belseje ekkor feltárul, és megjelenik egy rendkívül reakcióképes „kémiai reagens”, amely az eddig látszólag funkció nélküli fehérjéket stabilan (kovalens kötéssel) „rágyógyítja” a közeli sejtfelszínre. Ezek a fehérjék tehát rákötődnek egy mikrobára vagy egy veszélyesen megváltozott sejtünkre, és egyfajta jelként, stigmaként szolgálnak. Az immunrendszer megfelelő sejtjei részben ebből a stigmából értesülnek arról, hogy a sejtet be kell kebelezni és el kell pusztítani. A jelölési folyamatot opszonizációnak nevezik. Olyasmi ez, mint amikor a fertőzött épületet megjelölik a fertőtlenítést végző hatóság, vagy a beteg fákat a favágók számára.
Ökonomikus módon nemcsak az eltávolítandó sejtre tapadó nagyobbik C3 és C4 fehérjedarab, hanem a kisebbik, a vérben elúszó rész is jelként szolgál: immunsejteket ébreszt föl, jelzi számukra, hogy a környezetükben megjelent egy elpusztítandó objektum, amit meg kell keresniük. A jelölés mellett ez a riasztás a második komplementrendszer-funkció.
A harmadik szerep a betolakodó közvetlen, azaz falósejtek nélküli megölése. Ez sem azt jelenti, hogy a proteázok „lerágnák” a mikrobákról a fehérjéket. Ehelyett a „stigma” fehérje környezetében, a betolakodó felszínén, részben proteázos hasítás révén, egy fehérjékből álló csatorna szerelődik össze a megtámadott sejt membránjában. Olyan, mintha egy mindkét végén nyitott hordót építenének a membránba, amikor kifúrják. Ez természetesen nem tesz jót a sejtnek, egyrészt kifolyhat a belseje, de eközben a külvilágból is nagy mennyiségben juthatnak be olyan anyagok, például kalciumionok, amelyek a sejt jelátviteli útvonalainak megzavarásával a sejt pusztulásához vezetnek.
Nem beszéltük még meg a komplementrendszer harmadik ágának, az alternatív útnak a működéséről.
A stigmát szolgáltató C3 molekulát, amelyről már mondtam, hogy nagy koncentrációban úszik a vérben, nem csak a komplement proteázok aktiválhatják: spontán folyamatban is átmehet olyan alakváltozáson, aminek a révén C3 stigma kerül a sejtekre. Ez kis intenzitású, de állandóan zajló folyamat – minden normális, egészséges sejt életében előfordulhat, hogy ilyen módon rákerül a stigma; a jól működő, egészséges sejtek azonban gyorsan „lemossák magukról a graffitit”.
Az alternatív út fölhasználja ezt a spontán folyamatot – ha lát egy jelet, stigmát, akkor a felhasználásával még egy csomó ugyanolyan jelet gyorsan mellétesz. Említettem, hogy a másik két útvonal is gyárt ilyen jeleket. Az alternatív út nem válogat: a spontán felkerült és a másik két útvonal által felhelyezett stigmákat egyaránt megsokszorozza. Az alternatív út emiatt a komplementrendszer egyfajta beépített erősítője. Szabályozásával a komplementválasz intenzitása hasonlóan befolyásolható, mint a „tekerőgombbal” (potenciométerrel) egy rádió hangereje, vagy egy lámpa fényereje.
A három út tehát három különböző jelet észlel – ősi veszély-mintázatokat, lerakódott ellenanyagokat és a védekezés híján spontán, vagy a másik két út működése révén lerakódó stigmát. Amint a sejten stabilan megmarad akár a spontán módon, akár a klasszikus vagy a lektin-úton keletkező stigma, az alternatív út lavinaszerű folyamatban fölszorozza ezt a stigmát. Ennek trükkje részletesebben az, hogy éppen a már lerakódott stigma segítségével ébreszt fel egy olyan enzimet, a B-faktort, amely további vérben úszó C3 fehérjék hasításával további stigmákat „pakol le”, és ezekkel is újabb B-faktor-molekulákat ébreszt fel. A lerakódott stigmához tapadó B-faktor felébresztője nem más, mint az alternatív út kulcsenzime, a D-faktor.
A felfedezés középpontjában is a D-faktor áll.
A proteázok szinte kivétel nélkül alvó állapotban vannak a vérben, és szinte kivétel nélkül speciális jel ébreszti fel őket. A D-faktorról, amit hetven éve fedeztek fel, annyit tudtunk, hogy eleve el van hasítva, tehát a hasított, aktív forma úszik a vérben. Ezért eredetileg úgy gondolták, hogy a D-faktort eleve hasítva termelik a zsírszövet sejtjei, amelyek a vérbe juttatják.
A lektin-úton három enzim aktiválódik, a MASP-1, MASP-2, MASP-3. Korábban azt is mi tisztáztuk Gál Péter csoportjával, hogy milyen viszonyban áll a MASP-1 és a MASP-2 – teljesen másban, mint korábban hitték. Míg korábban a MASP-2 enzimet főszereplőnek, a MASP-1 enzimet pedig mellékszereplőnek hitték, mi igazoltuk, hogy ezek valójában egyenrangúan fontosak. Előző projektünk egyfajta megkoronázásaként2, 2012-ben a neves PNAS folyóiratban3 közöltük Héja Dávid doktorandusz „elsőszerzőségével” a lektin-út aktivációjának új modelljét, ami korrigálta a korábbi hibás modellt. Pár hete értesültem róla, hogy a leghíresebb nemzetközi immunológiai tankönyv legújabb kiadásába már betették az eredményünket, idézve a korrigált modellt. Ez nyilván annak köszönhető, hogy ennek a tankönyvnek a korábbi kiadásaiban is a hibás mechanizmus szerepelt, amit mi „raktunk helyre”. A MASP-3 tizenöt éve ismert, és ha a MASP-1 enzimről azt mondtam, hogy (hibásan) mellékszereplőnek hitték, akkor a MASP-3 esetében azt mondhatom, hogy legfeljebb statisztának szánták. Bár a felépítéséből látszott, hogy képesnek kellene lennie más fehérjék hasítására, másfél évtizeden át úgy tűnt, valójában semmilyen más fehérje hasításával nem járul hozzá a komplementrendszer működéséhez.
Most kell tennünk egy rövid kitérőt: posztdokként egy évig a Genentechben dolgoztam. Ez az egyik vezető biotechnológiai cég, a fehérje-gyógyszerek élvonalbeli kifejlesztője. A Genentech Fehérjemérnöki Intézetében sajátítottam el az „irányított fehérje-evolúció” szemléletmódját és módszertanát: fehérjéket evolválunk, ha úgy tetszik, kémcsőben. Így már létező fehérjékből létre tudunk hozni olyan változatokat, amelyek a természetből nem ismert funkciókat látnak el. Ennek az alapkutatásban és a gyógyászatban is nagy haszna lehet, mert az összes életfunkciónk mélyén, akármilyen meglepő, fehérjék egymáshoz – vagy más molekulákhoz – való rövidebb-hosszabb ideig tartó összekapcsolódása áll. (Például az oxigén szállításakor a hemoglobin ideiglenesen megfogja az oxigént, aztán elereszti.) Ebbe a kapcsolódási folyamatba úgy avatkozhatunk be a legprecízebben, hogy a sok tízezer fajta fehérjéből egyetlen egyet akadályozunk meg abban, hogy hatékonyan megkösse a szokásos partnereit. Ki kell tehát fejlesztünk egy olyan fehérjét, amely csak ehhez az egyetlen fehérjéhez kötődik. Azt is mondhatnám: a fehérjetársadalomban úgy derítjük ki, hogy kinek mi a szerepe, hogy megakadályozzuk annak végrehajtásában. Remélem, szemléletes példa, hogy amennyiben megakadályoznánk, hogy a pék dolgozzon, eltűnne a boltból a kenyér, a kifli és a zsemle, ami világosan mutatná, hogy miben is áll a pék feladata.
Magyarországra visszatérve, 2006-ban megalapítottam az ELTE Biokémiai Tanszékén az Irányított Fehérje-evolúció Kutatócsoportot. Ekkor keresett meg Gál Péter – aki jelenleg az MTA Természettudományi Kutatóközpont Enzimológiai Intézetében a Szerkezeti Biofizikai Kutatócsoportot vezeti – egy érdekes tudományos problémával. Elmondta, hogy az általa régóta kutatott lektin-út-proteázoknak, illetve magának a lektin-útnak a pontos szerepét rendkívül nehéz feltárni, mert a természetben nem léteznek ehhez szelektív inhibitorok (a működésüket gátló molekulák). Ismerve korábbi, proteázokkal és proteázinhibitorokkal kapcsolatos kutatásaimat, valamint az irányított evolúcióban rejlő lehetőségeket, Péter együttműködésre kért fel, amit örömmel elfogadtam. Akkori beszélgetésünkből egy ma már tízéves kollaboráció született. Sorban kifejlesztettük a laboromban a MASP-1, a MASP-2 és a MASP-3 enzimek inhibitorát, és az egymást kiegészítő tudásunknak, valamint rendkívül tehetséges doktoranduszok részvételének köszönhetően számos komoly eredményünk született. A MASP-1 és MASP-2 szelektív inhibitoraival értük el a korábban már említett első komoly közös eredményünket, a lektin-út-aktiválódás valódi mechanizmusának feltárását. Az idevezető kísérletsorozatban elsősorban Kocsis Andrea és Héja Dávid doktoranduszok vettek részt.
Utoljára a MASP-3 szelektív inhibitora készült el Szakács Dávid doktorandusz munkája nyomán, de ez a gátlószer az összes szokásos vizsgálatban hatástalannak bizonyult. Igazolódni látszott, hogy a statisztának tekintett MASP-3 valóban semmit sem csinál. Csakhogy éppen ebben az időszakban Gál Péter csoportjának főmunkatársa, Dobó József elindított egy kutatást a D-faktor-aktiváció vizsgálatára, melyben a munka dandárját Oroszlán Gábor doktorandusz végezte el. Mesterségesen előállították a D-faktor alvó formáját (a vérben, ahogy említettem, csak az aktívat látjuk). Ezt megjelölték egy fluoreszkáló festékmolekulával, betették a vérbe, és vizsgálták, vajon elhasad-e. A fluoreszcens jelnek köszönhetően a sok ezer másfajta fehérje jelenléte ellenére is szelektíven látható volt a D-faktor, és mivel a hasított, „felébresztett” forma egy adott elválasztási technikát alkalmazva máshová vándorol, mint az ép, az esetleges hasítás is tetten érhető volt. Mint kiderült, a D-faktor elhasadt a vérben! Tehát a zsírsejt nem hasítva „köpi ki” magából – különben mire szolgálna a vérben kimutatott feldolgozó apparátus?
Ekkor első menetben bevetettük a MASP-1 és a MASP-2 inhibitorunkat, de ezeknek nem volt hatásuk. A MASP-3 inhibitor hatására azonban a hasítás teljes mértékben elmaradt! A MASP-3 inhibitor ebben az egyetlen tesztben „szólalt meg”, de ezzel egy csapásra megoldódott két régóta kutatott rejtély.
Azonnal világossá vált, hogy az alapállapotban lévő (alvadásos és gyulladásos folyamatokkal nem befolyásolt) vérben a „csúcsragadozó” D-faktor felébresztése kizárólagosan a MASP-3 feladata. Megoldódott tehát a D-faktor-aktiváció több évtizedes rejtélye, de egyúttal fény derült a MASP-3 szerepének tizenöt éves rejtélyére is.
A MASP-3 szerepét a korábbi vizsgálatainkban azért nem tudtuk detektálni, mert mire a vérmintákat elkezdtük vizsgálni, a vérben lévő MASP-3 már elvégezte a munkáját: a vér saját D-faktor-állományát a vizsgálat idejére már rég elhasította, így hiába adtunk be inhibitort.
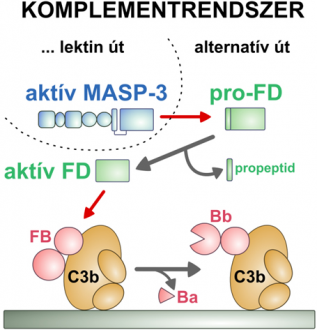
A D-faktor (FD) a komplementrendszer alternatív útvonalának kulcsenzime. Feladata az alternatív út beindítása a B-faktor (FB) alvó alakjának aktiválásával. Az alvó B-faktor a C3b stigmára kötődik, amely a C3-ból keletkezik, háromféle úton. (A B faktor aktiválása után keletkező, C3b-hez kötött Bb fragmentum C3 fehérjét hasító enzim, amely újabb C3b stigmákat állít elő. A D-faktor így sokszorozza meg a B-faktor közreműködésével a stigmákat.)
A D-faktor „propeptidet” is tartalmazó, alvó formában keletkezik (pro-FD). A mostani kutatás derítette ki, hogy a D-faktort pro-FD formájából a korábban ismeretlen szerepű MASP-3 aktiválja
Hogyan hasznosulhat az új tudás a gyógyításban?
Eddig mindenki azt gondolta, hogy a D-faktor eleve aktiválva kerül a vérbe, és ezért logikusnak tűnt, hogy elsősorban a D-faktor gátlásán keresztül lehetne korlátozni az alternatív út komplementválasz-erősítő funkcióját. A kizárólagos aktivációs út feltárásával azonban sikerült egy vadonatúj célpont-molekulát azonosítanunk a gyógyszerfejlesztés számára, ami nem más, mint a MASP-3 enzim. Ha egy élőlényben folyamatosan gátolva tudnánk tartani a MASP-3-at, akkor a vérbe jutó D-faktor alvó állapotban maradna, nem érvényesülne az alternatív út válasz-sokszorozó hatása. És valóban, ha hibás a MASP-3-at termelő gén, akkor bizony alvó állapotú D-faktor van a vérben, és az alternatív út nem működik.
Miért érdemes gátolni a D-faktor működését? Úgy tudjuk, egyes krónikus betegségek előrehaladását késleltetheti vagy megszüntetheti a D-faktor szintjének csökkentése. Ilyenek például egyes vesebetegségek vagy az időskori vaksághoz vezető makuladegeneráció. A jelenlegi tudás szerint ezek kordában tartásához lényeges mértékben kéne csökkenteni a D-faktor koncentrációját, és mivel krónikus betegségekről van szó, a hatást, és emiatt a gyógyszermolekula szintjét folyamatosan fenn kéne tartani. Ez két fontos megoldandó feladatot is ró majd a gyógyszerfejlesztőkre.
Egyrészt terápiás célra olyan MASP-3 gátló gyógyszermolekula felelhet meg, amelynek szintje stabilan magasan tartható a szervezetben. Elképzelhető, hogy erre egy szelektív MASP-3 gátló ellenanyag lesz majd a megoldás.
Annak érdekében, hogy ez a folyamatos blokkolás ne járjon a teljes szervezetre kiterjedő immunhiányos állapottal, a gátlást a betegség által érintett területre, például a retinára vagy a vesetestecskékre kell korlátozni.
Ez egyáltalán nem triviális feladat, felfedezésünk mégis bizakodásra ad okot. Minden új, alapvető ismeret, amely feltárja egyes életfolyamatok molekuláris mechanizmusát, új működési elvű gyógyszerek kifejlesztését teszi lehetővé.
2016. szeptember
------------------------------------------------------------------
1 A komplementrendszer aktiválódási mechanizmusa és élettani szerepe: átfogó vizsgálat irányított evolúcióval kifejlesztett, útvonal-szelektív inhibitorokkal (NK 100769).
2 Fehérje-kölcsönhatások szerkezeti alapjainak feltárása és a kölcsönhatás szelektív gátlása irányított evolúciós eljárásokkal (K 68408).
3 PNAS: Proceedings of the National Academy of Sciences of the United States of America.