|
| Katona István |
A fontosabb eredményeinkről írunk egy egyoldalas összefoglalót, amely megjelenik az intézet honlapján. Az Akadémia új sajtóosztálya ezekből a hírekből készít közérthető, képes, profi beszámolót.
Éppen a közérthetőségre akartam kitérni: az ember azt hiszi, hogy minden szavát érti ennek a blickfangos címnek – ellentétben például egy kutatási pályázatéval –, pedig ez is ugyanolyan bonyolult jelentést hordoz, mint egy szakmai beszámoló címe.
Nagyon hálás vagyok az összeállítást készítő csapatnak, mert sokkal jobb cikkel rukkolt elő, mint amilyet mi írtunk volna – és szívesen olvasom a mások eredményeiből készülő, hasonló összeállításokat is.
Most mégis öntől szeretném kérni, hogy tárja fel ennek a címnek a jelentését.
Csoportunk kutatási témája – amely Freund Tamás programjából „nőtt ki” – a belső kannabinoid-rendszer.1 Körülbelül ötezer éve ismert, hogy a kannabisz növény markánsan befolyásolja a viselkedésünket. A kínai orvoslásban fájdalomcsillapításra szolgált a műtétek során, de azt is tudták, hogy rendszeres használata démonokkal való találkozáshoz vezet. Az elmúlt évtizedek orvostudományi eredményei az okokat is megmutatták: találtak a szervezetünkben egy olyan jelpályát, amelynek a működését befolyásolják a kannabisz hatóanyagai. Ezek közül a legismertebb a pszichoaktív THC2.
Kutatócsoportunk körülbelül tizenöt éve ezt a jelpályát tanulmányozza: milyen fontos molekulák játszanak benne szerepet, mikor és hol – az idegrendszer melyik részén – aktív, milyen betegségek köthetők hozzá. Az utóbbi pár évben két nagyon érdekes orvostudományi eredményünk született. Az egyikhez az Országos Klinikai Idegtudományi Intézetben dolgozó orvoskollégákkal, a KOKI-s Freund Tamással és Maglóczky Zsófival, illetve Ludányi Anikó PhD-hallgatóval jutottunk el. Az találtuk, hogy az endokannabinoid-jelpálya molekuláris elemei eltérően is reagálhatnak epilepszia esetén: a serkentősejtekben a szokásosnál sokkal kevesebb lesz a kannabinoid-receptor, a gátlósejtek egy részében pedig növekedés mutatkozik, vagy nincs változás. Ez arra figyelmeztet, hogy nem kezelhetjük az agyat egyetlen egységként, hanem a sejttípusokat is vizsgálnunk kell, mert a molekulák eltérő módon változhatnak meg a beteg szervezetben.
A másik érdekes kísérletben Chris Henstridge skót vendégkutatóval egy súlyos szellemi fogyatékossággal járó betegséget vizsgáltunk egérmodellben. Ez a betegség, a törékeny X szindróma, egy gén fehérjetermékének a hiányából fakad. Meglepetésünkre most nem azt találtuk, hogy a belső kannabinoid-molekulákat előállító enzimfehérje változik meg a betegség miatt, hanem azt, hogy ez az enzim 100 nanométerrel (egy hajszál vastagságának kb. ezredrészével) eltolódik a szokásos helyzetéhez képest. Emiatt a 100 nanométeres elcsúszás miatt nem működik „rendesen” az endokannabinoid-jelpálya ebben az egérmodellben! A kísérletet amerikai és francia kutatókkal publikáltuk a Nature Communicationsben 2012-ben.
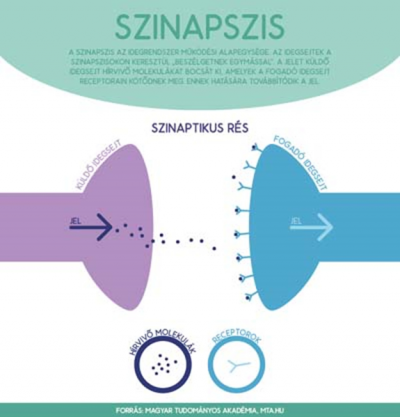
Ez a két eredmény – az első tehát azt mutatta, hogy a sejttípusok szintjén kell dolgoznunk, a második pedig azt, hogy nanométeres pontossággal kell mérnünk a fehérjék helyi mennyiségének változását – vezette a csoportunkat az új, szuperrezolúciós technikák felé. Ezek a módszerek forradalmat jelentenek az élettudományokban. Körülbelül a 2000-es évek közepén jöttek rá, hogyan „játsszák ki” az optikai mikroszkópok korlátozott felbontását, amit a fényszóródás okoz. Az egyik eljárást a pointillizmushoz hasonlíthatjuk: több ezer jelmolekulát egyenként, egymás után helyezünk el ugyanazon a képen, több különböző képet készítünk, ezeket egymásra fektetjük, és a folyamat végén feltárul például egy idegvégződés pontos molekuláris felépítése. Óriási szerencsénk volt, mert 2010-ben az intézetünkbe került az első európai szuperrezolúciós rendszer. Az a cikkünk, amiről az Akadémia honlapja is beszámolt, és nagy port fel, jórészt mikroszkópos fejlesztés eredménye. Elsődleges céljaink között szerepelt egy olyan eljárás kidolgozása, amellyel az agykutatók több száz- vagy akár ezerféle idegsejt-típus közül már egyet is külön vizsgálhatnak. Így a több tízezer fehérje közül kiválaszthatják azt az egyetlen egyet, amelyet tanulmányozni akarnak, és bármilyen betegség vagy élettani folyamat esetén nanométeres pontossággal (!) követhetik, hogyan változik ennek a fehérjének a mennyisége. Ezek a mikroszkópok körülbelül 10 nanométer pontossággal állapítják meg egy fehérje helyét, ami azért fontos, mert az idegrendszer „kulcs”-struktúrája, a kémiai szinapszis mérete ebbe a nagyságrendbe esik – az idegsejtek pedig a szinapszison keresztül beszélgetnek úgy, hogy az első jelmolekulákat küld a másodiknak.
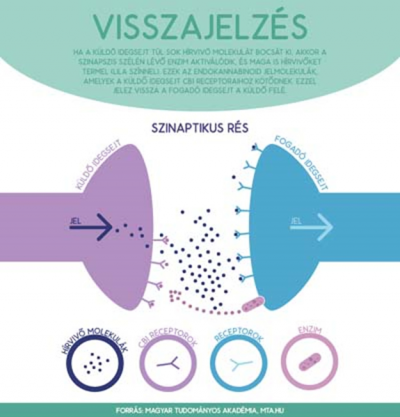
Ezzel szemben, amikor a kilencvenes évek végén a PhD-dolgozatomat írtam, Freund Tamással azt találtuk, hogy az a kannabinoid-receptor, amit a marihuána hatóanyaga, a THC és a belső kannabinoid-molekulák aktiválnak, az idegvégződéseken ül. Később Urbán Gabriella kolléganőmmel kimutattuk, hogy az az enzim, amely a belső kannabinoidot termeli, a másik, a fogadó idegsejten van: ebben a jelpályában visszafelé beszélgetnek az idegsejtek. Tehát a kémiai szinapszisok nemcsak egyenirányítóként működnek, hanem létezik egy visszacsatoló, feedback rendszer is, és ez az endokannabinoid-jelpálya fő szerepe.
Önök fedezték fel először a „visszabeszélés” jelenségét?
Nem. Az 1990-es évek elején Alain Marty francia és Bradley Alger amerikai kutatócsoportja állapította meg, hogy léteznie kell visszabeszélésnek. Nagy keresés indult a folyamatban szereplő jelmolekula megtalálására. 1999-ben fedeztük fel Freund Tamás csoportjában, hogy idegvégződéseken található a kannabinoid-receptor. Írtunk egy cikket, amelyben azt is felvetettük, hogy ez a kannabinoid-receptor alkalmas lehet erre a visszabeszélésre. Utána, nagy örömünkre, két amerikai és egy japán kutatócsoport közvetlen bizonyítékot adott az endokannabinoid-jelpálya ilyen viselkedésére.
A nagy kérdés ezután az volt, hogy melyik endokannabinoid és melyik enzimfehérje szerepel ebben a jelátvitelben. A következő komoly „budapesti eredmény” egy 2006-os cikkünkben jelent meg: megmondtuk, hogy pontosan melyik enzimről van szó, és az pontosan hol található a szinapszis másik, posztszinaptikus oldalán. Ezzel feltárult ennek a szinaptikus jelpályának a molekuláris szerveződése. Úgy gondolom, az alapelveket most jórészt értjük, és a következő években, évtizedekben a terület kutatói felderíthetik, milyen szerepet játszhik az egyes betegségekben az enzim és a receptor szokásostól eltérő működése. Mi ehhez is próbálunk segítséget nyújtani azzal a szuperrezolúciós eljárással, amely most először a világon képes megmutatni, hogy egyetlen egy idegsejtben hogyan változik egy fehérje mennyisége. Ebben oroszlánrésze van Dudok Barna biológus és Barna László mérnök-fizikus kollégáimnak.
A „visszabeszélés” hipotéziséhez visszatérve hadd jegyezzem meg, hogy laikusként inkább a fizikából ismerek híres eseteket, amikor egy megjósolt jelenséget később igazolnak kísérletekkel.
A biológiában ez nagyon gyakori, és úgy gondolom, azé az igazi dicsőség, aki bizonyítja a feltevést. Mi másképp dolgozunk, mint a fizikusok: megfigyelünk valamit, és leírjuk, hogyan kell szerintünk működnie – az elgondolást utána az tesztelheti, akinek jó módszerei, technikái vannak. 1999-ben még gyerekcipőben járt a fordított irányú jelátvitel bizonyításához szükséges metodikánk, de örülök, hogy így is fontos eredménnyel járultunk hozzá a jelpálya megismeréséhez. Bízom abban, hogy a szuperrezolúciós munkánkat is értékelik majd, mert eddig nagyon kedvező visszajelzéseket kaptunk.
Hogyan tesznek egyetlen fehérjét láthatóvá?
A biológiában a mérnöki megoldások akkor a legsikeresebbek, ha kihasználjuk az élővilág mérnöki trükkjeit – a természetnek hosszú ideje van a legoptimálisabb technikai megoldás megtalálására. Erre a madárevolúcióból szeretek példát hozni. A sasok, a baglyok és a sólymok egyáltalán nem rokonok. Mégis, ha csak a csőrüket látnám egy fényképen, nem tudnám megmondani, melyik állathoz tartoznak. Ez arra utal, hogy ez a csőrforma a legideálisabb a hús tépésére: az evolúció ehhez a technológiai megoldáshoz háromszor is eljutott. A biológia elmúlt évtizedekben kifejlesztett, természeti jelenségen alapuló módszertani csodái közül a leghíresebb talán a színes zöld fluoreszcens fehérje (GFP), amely egy medúzában található: ma a biológusok ezzel „világítják meg” a fehérjéket. Így mutathatjuk ki, például, hol helyezkedik el egy fehérje az élő sejtben.
Mi egy másik evolúciós trükköt használunk: az antitesteket. Amikor egy kórokozó megtámadja a szervezetünket, az immunsejtek olyan molekulákat, antitesteket termelnek, amelyek segítenek ennek a kórokozónak az elpusztításában. Például egy nyúl immunrendszerét be lehet úgy csapni, hogy olyan antitestet készítsen, amely az egérben található kannabinoid-receptort ismeri csak fel. Amikor az agymetszethez hozzáadjuk a nyúl által termelt, specifikus antitestet, akkor ez megkeresi a szövetben a célpontját, esetünkben a kannabinoid-receptort. Ha pedig az antitesthez világító, fluoreszcens molekulát kapcsolunk, akkor a receptor helyét is meg tudjuk állapítani a mikroszkópban. Ezt az eljárást immunfestésnek nevezik. Kacskovics Imre csoportja az ELTE-n különleges, transzgenikus nyulakat fejlesztett ki, amelyek a szokásosnál sokkal hatékonyabban készítenek antitesteket, és mi az ő antitestjeik segítségével tudtuk ebben a Nature Neuroscience-tanulmányban megfigyelni a struktúráinkat. Ma már rengeteg országban használják a nyulaikat antitest-termelésre.
Mit láttak, amikor megfestették az enzimet és a receptort?
Az első fontos kérdés az volt, hogy a különböző sejttípusokon más törvényszerűségek érvényesek-e a receptor eloszlására. Mi két gátlósejt-típust hasonlítottunk össze. Érdekes módon találtunk néhány olyan elvet, amely igaz volt mind a kettőre, de találtunk néhány különbséget is. Ezek, reményeink szerint, magyarázatul szolgálnak arra, hogy a két sejttípusban más az endokannabiod-jelpálya hatékonysága.
A másik fontos kérdésünk úgy szólt, hogy alkalmas-e ez az új mikroszkópos eljárás a molekuláris változások nyomon követésére. Még a kilencvenes évek elején kialakult egy kísérleti paradigma a rekreációs marihuánafogyasztás vizsgálatára, amit a kannabinoid-kutatók ma is használnak. Ez arra keresi a választ, hogy milyen tolerancia alakul ki a tartós THC-adagolás (a marihuána hatóanyagának) hatására. Eddig nem tudtuk, hogy pontosan mi történik a receptorokkal, de most azt találtuk – ami számomra is nagyon meglepő volt –, hogy a receptorok körülbelül 85 százaléka eltűnik az idegvégződések felszínéről. A biológiában már a 20–25 százalékos hatást is nagyon erősnek szoktuk gondolni. Ezúttal a receptorok 75 százaléka teljesen eltűnt az idegvégződésről, 10 százalék pedig bekerült az idegvégződés belsejébe.
Izgalmas újabb kérdés, hogy mennyire tartós ez a folyamat, mikor „jön vissza” a receptor. Ezért az egyik kísérletünkben a THC alkalmazása után az egerek hat hétig nem kaptak THC-t. A agymetszetek vizsgálatából azt láttuk, hogy két hét után csak a receptorok fele jött vissza, és hat hét után állt vissza az eredeti mennyiség.
Az orvosi kannabisz-használat számos országban egyre elfogadottabb, például a szklerózis multiplex esetében már 26 országban engedélyezik. Az orvosi kannabisz THC-dózisa tizede a rekreációs célúnak. Hosszú távon talán az a legfontosabb biológiai eredményünk, hogy ez a dózis hatnapos kezelés után csak 15 százalékos receptor-szintcsökkenést okozott. A THC-hatás tehát dózisfüggő: nem mindegy, hogy milyen koncentrációjú THC jut a szervezetbe, és annak milyen molekuláris következményei lesznek.
Mit jelent, hogy a receptorok eltűnnek az idegvégződésekről?
Lebontja őket a sejt, ezért a belső kannabinoidok nem találják meg a receptoraikat. Emiatt az endokannabinoid-jelpálya nem működhet megfelelő hatékonysággal, és nem tudja végrehajtani azt a finomhangolást, ami a feladata lenne.
Tegnap olvastam, hogy Oregon államban olyan szmókert keresnek, aki rendszeresen értékeli a piacon levő, engedélyezett füveket, és havonta kétszer beszámolhat róluk egy helyi lapban…
Van egy több ezer éves gyógynövényünk, amelynek nagyon sok hasznos terápiás alkalmazása lehet, nagyobb dózisban eufóriát vált ki, ezért sokan élvezeti szerként is használják. De azt is tudjuk több ezer éve, hogy a rendszeres használata komoly károkat is okozhat.
A kannabisz kemény tiltása az elmúlt évtizedekben két nagy problémához vezetett. Egyrészt a feketepiacot egyetlen társadalom sem tudta kordában tartani. Ennek az lett az eredménye, hogy a hatvanas években, amikor a hippik szívtak füves cigit, 1–2 százalék volt a THC-tartalmuk. Az a modell, amelyet mi használunk, a 90-es évek 3–4 százalékos THC-tartalmát követi. Most 13 százalék az átlag, de létezik 20–30 százalék THC-tartalmú termék is.
Másrészt a nagyon szigorú tiltás rendkívül megnehezítette az orvostudományi kutatásokat. Sem a terápiás célokat, sem a mellékhatásokat, a mellékhatások elkerülésének lehetőségét vizsgáló kutatásokra nem kerülhetett sor. Az a legalizálási folyamat, amely nemrégiben indult el, valószínűleg annak a beismerése, hogy a teljes tiltás politikája a társadalmat sem védi meg, és a potenciális hasznot sem aknázza ki. A kutatók viszont attól félnek, hogy az inga most átlendül a túloldalra. Miközben a kannabisz-fogyasztás hirtelen nagy divat lett, és már-már „sommelier”-ket keresnek, az amerikai orvostudományi folyóiratokban sorra jelennek meg a tanulmányok, hogy a rendszeres kannabisz-fogyasztás miért nagyon kockázatos. Az Amerikai Egészségügyi Intézet (NIH) egyik vezető kutatója, Nora Volkow összefoglaló tanulmányában arról ír, hogy bár a hatásmechanizmusról még keveset tudunk, sok komoly mellékhatás már ismert, amivel minden füvezőnek tisztában kellene lennie. A mi munkánk arra hívja fel a figyelmet, hogy a dózis egyáltalán nem mindegy a molekuláris következmények szempontjából, és az sem mindegy, hogy mennyire tartósan kapja valaki a THC-t.
Legújabb pályázatából kiderül, hogy találtak egy eddig ismeretlen enzimet, amellyel másképpen keletkezik egy belső kannabinoid, mint ahogy eddig gondolták. Sőt, a „szálak” az idegrendszerből is kivezetnek, amit meglepő fejleménynek gondolok.
Mi is… Az intézetünk kannabinoid-kutatásának elindulása nekem életre szóló tanulsággal szolgált – azzal, hogy az igazán nagy áttörések megjósolhatatlanok, és az a jó kutatástámogatási rendszer, amely esélyt ad arra, hogy a váratlan fordulatokból is sikeres munka bontakozhasson ki. A kilencvenes években Freund Tamás csoportja a világ egyik vezető gátlósejttípus-kutatócsoportja volt. Tamás több gátlósejt-típust fedezett fel a tanítványaival. Az egyik különleges gátlósejtet nem lehetett jól vizsgálni, nagyon keveset tudtunk róla. Tamás egy konferencián gátlósejteket vett észre az egyik poszteren, és kiderült, hogy a szerzők azt az antitestet tanulmányozzák, amelyik a kannabinoid-receptort ismeri fel. Elkérte ezt az antitestet, és amikor elkezdtünk vele dolgozni, még nem is igen tudtunk a belső kannabinoid-rendszerről (azokban az években fedezték fel). Bennünket az érdekelt, hogy végre van egy eszköz a kezünkben, amellyel egy izgalmasnak tűnő gátlósejt-típust vizsgálhatunk. Nagyon sokat meg is tanultunk erről a gátlósejtről, de a munkánknak végül is az lett a legnagyobb értéke, hogy a belső kannabinoid-jelpálya működésének megértéséhez vezetett. Ezt senki sem tudta megjósolni.
A mostani pályázat az európai uniós kutatási programom váratlan következményeként született. Az egyik nagy kérdésünk az volt: miért van szükség sokféle endokannabinoidra? Az a szinaptikus endokannabinoid-jelpálya, amelyről eddig meséltem, nagyrészt egy 2-AG becenevű endokannabinoidot használ3, de létezik egy másik endokannabinoid is, az anandamid – aminek a neve belső boldogságot jelent. Az anandamidot korábban fedezték fel, de az élettani és kórélettani jelentősége nagyrészt rejtve maradt. Az is kiderült, hogy az anandamid készítését számos enzim segítheti elő, és mi ezeket kezdtük el tanulmányozni. Ennek kapcsán jelent meg egy biokémiai tanulmány arról, hogy egy Abhd4 nevű enzim4 is képes anandamid előállítására. Erről az enzimről összesen három-négy tanulmány érhető el még csak az interneten. A kollégáimmal elkezdtük vizsgálni ezt az enzimet, és egészen váratlan előeredményekre bukkantunk, amelyek rendkívül érdekes kutatáshoz vezethetnek. Azért kértük a mostani támogatást, hogy el tudjuk indítani ezt a munkát. Az eddigi eredmények egy részét lassan már publikálhatjuk, de mindegyik olyan új kérdést vet fel, amire nem is gondoltunk korábban. Ezek a kérdések annyira izgalmasak, hogy több kollégám is úgy döntött: hajlandó éveket adni az életéből a megválaszolásukra. Remélem, ez a munka is olyan évtizedes program lehet, mint az endokannabinoid-jelpálya kutatása.
A támogatás jóval rövidebb időre szól… Hogyan tarthatják életben Magyarországon az ilyen jelentős és drága kutatásokat?
Két válaszom van. 1993-ban, 19 évesen kezdtem dolgozni a Szigony utcában, a 8. kerület szélén. Ebben az időben autók robbantak a szomszéd utcákban a maffia-leszámolások miatt. Freund Tamás mégis idejött Oxfordból, itt alakított ki nagyszerű laboratóriumot, és itt nevelt fel 15–20 olyan tanítványt, aki a maga területén ma már a világ vezető kutatója. Akkor sokkal nehezebb körülmények között kellett boldogulnunk, mint most, mégis komoly értékek születtek. Ebből erőt kell meríteni. Igaz, hogy Tamás generációjából csak egy-két kiemelkedő kutató jött haza, de a következő generációból – Acsády László, Nusser Zoltán, Tamás Gábor generációjából – már körülbelül a legjobb egy százalék, amely itthon is világszínvonalú kutatást folytathat. Főleg a Lendület-pályázatnak köszönhetően az én generációmból – a hetvenes években születettek közül – már 10–15 százalék dolgozhat itthon komoly eredményeket felmutatva. Nagyon bízom abban, hogy a magyar tudományfinanszírozás hamarosan eléri legalább a közepes európai támogatási szintet, és akkor már az a 25 százalék mind itthon lesz, amely megérdemli a támogatást. Most is említhetnék számos fantasztikus kollégát, aki rendszeresen publikál a világ vezető folyóirataiban, de nem sikerült még hazacsábítani – mert attól tart, hogy ha kap is öt évig támogatást a Lendület-programból, nem tudja, mire számíthat utána, hiányzik a hosszú távú kiszámíthatóság. Ezért inkább Amerikában vagy Nyugat-Európában maradnak. Én optimista vagyok, és nagyon remélem, hogy a következő években már mind a 25 százalék legtehetségesebb, legkeményebben dolgozó kolléga itthon kutathat.
A másik válasz: mi igazából egyet tehetünk – a legjobb tudásunk szerint dolgozunk, a legnehezebb kérdéseket próbáljuk megválaszolni, és bízom abban, hogy ez támogatásra talál a következő években is.
A tehetségen kívül nagyon sok pénz kell a kutatáshoz.
Elmondtam az intézetben is, hogy ezt a kutatási programot csak akkor tudom Magyarországon elindítani, ha megkapjuk az NKFI támogatását, ami hatalmas segítség, és nagyon örülünk neki. Habár összegében így is jóval kisebb, mint amerikai versenytársaink átlagos „grant”-jei, de remélem, előeredményeink alapján van annyi versenyelőnyünk, hogy a néhány legfontosabb kérdést mi tudjuk majd elsőként megválaszolni.

Silberer Vera
--------------------------------------------------------------
[1] A szövegben szereplő „belső kannabinoid” és „endokannabinoid” kifejezések jelentése azonos.
[2] THC: tetrahidrokannabiol; ennek egyik izomere, a transz-D9-tetrahidrokannabiol a legaktívabb.
[3] 2-Ag: 2-arachidonglicerol.
[4] Abhd4: abhidroláz 4.