
Reményi Attila biológus, az MTA Természettudományi Kutatóközpont tudományos tanácsadója
Az Élvonal-pályázatából kiolvasható, hogy egy hosszú folyamat részeként tekint a következő évek munkájára.
Azok a fehérjecsoportok – a MAP-kináz nevű enzimek –, amelyekkel dolgozom, a sejtosztódásban (például a rákbetegség során) és a sejthalálban (a krónikus gyulladásos folyamatokban) játszanak központi szerepet.
A kutatást még a posztdoktori éveim elején kezdtem, 2002-ben. Akkor egy ún. modellszervezetben, élesztőben vizsgáltam, hogy a külvilágból érkező fizikai-kémiai (fény-, hang-, molekula-) ingereket hogyan dolgozzák fel a sejtek, és hogyan adnak a túlélésük szempontjából szükséges biológiai választ. A fehérjék közötti törvényszerűségek megértéséhez atomi szintű térképeket készítettem a ki- és bekapcsolt (aktivált) fehérjékről. Egy következő projektben atomi szintű molekuláris térképeket készítettünk, amelyek hozzájárultak az emberi sejtek viselkedésének magyarázatához, és ennek köszönhető, hogy megalapíthattam a Lendület-labort.
Ekkor már az is felmerült, hogy olyan molekulákat kellene használnunk, amelyekkel pontosan beavatkozhatunk a külső jelet közvetítő, bonyolult folyamatba, hiszen nagyon részletes ismereteket szereztünk a közvetítéshez szükséges fehérjékről. Úgy gondoltuk, ha olyan hatóanyagot terveznénk, amely képes két fehérje kapcsolatának a megszüntetésére, akkor ebből később gyógyszert lehetne fejleszteni. Az Élvonal-pályázat lényege, hogy az atomi szintről sokkal magasabb szintre ugrunk: azokat a mikroszintű információkat, amelyeket az atomi szintű történésekről már megszereztünk, olyan kísérletek tervezésére fogjuk felhasználni, amelyekkel globálisan értelmezhetjük a jelközvetítés, az egymással összefüggő jelpályák működését. Ehhez apró, célzott beavatkozásokat hajtunk végre.
Végül az atomoktól eljutnak a teljes rendszerig. Ezen a tudáson már gyógyítás is alapulhat.
A mi feladatunk elsősorban az útmutatás: arra kell rávilágítanunk, hogy egy jelenség megértésével hogyan lehet jobb hatóanyagot készíteni. A gyógyszerfejlesztés azután már a gyógyszergyárak dolga. Nekünk azt kell feltérképeznünk, hogy „ki kivel” kerül kölcsönhatásba és „ki kit” kapcsol be. Az Élvonal-projekt alapja a „designer sejt” ötlete: olyan sejteket hoztunk létre, amelyekben – ha akarom – csak azt az enzimet kapcsolom be, amelyik a sejtosztódásért, vagy azt, amelyik a sejthalálért felel. Mi közvetlenül a sejtben tapogatjuk le a jel útját.
Hogyan?
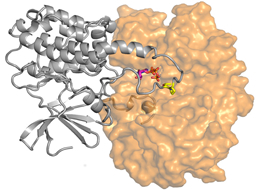
Molekuláris felvétel egy jelátviteli fehérje-fehérje komplexről.
Ilyen atomi szintű információk birtokában a sejtbiológiai folyamatok pontosabban megismerhetőek. A felvétel az ERK nevű MAP kináz (narancs) és egy sejtnövekedést serkentő végrehajtó fehérje.
Molekuláris felvételeim vannak például arról a fehérjéről, amelyik a sejtosztódásban szereplő enzimet, MAP-kinázt aktiválja és megnézem, hogy a válaszhoz milyen folyamatok következtek be a sejt fehérjéiben vagy a sejtosztódásban. Ilyen finom vizsgálatokra eddig nem került sor, mert a fehérjék közötti egyedi kapcsolatokat nem kezelték megfelelően. Mi tudatosan szeretnénk beavatkozni a folyamatokba, és ez lenne a személyre szabott gyógyszeres beavatkozások alapja is. Ezért folyok bele egyre inkább a célzott terápiákat kitűző projektekbe; például Győrffy Balázs NVKP-projektjében (Győrffy Balázsék világszinten egyedülálló megközelítése a gyermekkori szolid agytumorok „kiindulási” génhibáit analizálja egy számítógépes algoritmus segítségével). Fontos, hogy kontrollálható körülmények között teszteljünk hatóanyagokat.
Ezt nagyban segíti az infrastrukutrális háttér is, amelynél szintén az összefogásban hisz.
Úgy alakult, hogy én képviseltem Magyarországot egy nagy kémiai biológiai konzorcium, az EU-Openscreen (az EU-Openscreen egy 17 tagország biológiai és gyógyszervegyészeti kutatóközpontjai által létrehozott konzorcium, amelyhez Magyarország 2013-ban csatlakozott. A konzorcium 2016-tól kezdődően vállalta egy molekuláris farmakológiai szűrési szempontból átgondolt központi vegyületkönyvtár létrehozását). Az Európai Kutatási Infrastruktúra Konzorcium (ERIC), amely összehangolja az infrastruktúrák telepítését, az ELI mellett többek között az EU-Openscreent is felvette a programjába, de itt nem egy nagy infrastruktúra létesül, hanem több kisebb, több országban. Ezek nagy kapacitású, sok molekulát tesztelő, automatizált rendszerek lesznek, amelyek a hatóanyag-fejlesztést szolgálják.
Azokon az üléseken, ahol a kémiai biológiai konzorcium szakmai hátterét építettük fel, úgy láttam, már „le vannak osztva a lapok” az infrastruktúra-telepítésben, de meg lehet találni azt a rést, ahol nemzeti szinten hozzájárulhatunk a konzorcium munkájához. Ezt egy különálló, a Versenyképes Közép-Magyarországért Operatív Programból (VEKOP) finanszírozott projekt keretében igyekszem megvalósítani. Olyan rendszert szeretnénk kifejleszteni, amelyben például sejtbeli fehérjék kötésének erősségét, sejtbeli folyamatok lefolyásának sebességét tudjuk mérni. Ez a megközelítés ritkaságszámba megy. Az eredményeinket hatóanyagok optimalizálására használhatják a kutatók. A projektben az infrastruktúrát kell beüzemelnünk, de egy molekula-könyvtár létrehozását – vegyületek összegyűjtését, katalogizálását – is vállaltam, amely a kutatói közösség rendelkezésére áll majd. Ezzel a tárral csatlakozhatunk az EU-Openscreen nagy molekulakönyvtárához.
Mindehhez hányan dolgoznak a csoportjában?
Három szenior kutató, egy posztdoktor, öt PhD-hallgató és egy laboráns, tizenegyen vagyunk. A kutatási folyamat ívét így a „tudománymenedzsment” is követi: ma már olyan egységekben és együttműködésekben kell gondolkodnom, amelyek túlmutatnak a saját csoportom szintjén. Ez kihívás, felelősség, de egyben újabb lehetőség.






