A gyerekek körében sokkal kevesebb tumoros megbetegedés fordul elő, mint a felnőttekében, és a leggyakoribb gyermekkori daganatos betegség, a leukémia kezelése ma már gyakran teljes gyógyuláshoz vezet. A szolid (szilárd) tumorok esetében azonban ennél rosszabbak a kilátások. A Nemzeti Kutatási, Fejlesztési és Innovációs Alapból (NKFI Alap) támogatott Nemzeti Versenyképességi és Kiválósági Program egyik nyertes projektjének kutatói egyedülálló megközelítéssel szereznek új ismereteket a gyermekkori szolid tumorokról, és így hatékony gyógyszerek előállítását indíthatják el.

Győrffy Balázs és a projekten dolgozó kutatócsoportjának tagjai
A Nemzeti Kutatási, Fejlesztési és Innovációs Hivatal (NKFI Hivatal) a tematikus megkötés nélkül meghirdetett kutatás-fejlesztési programok támogatása mellett célzottan, a nemzetgazdaság szempontjából kiemelkedően fontos, konkrét tudomány- és szakterületekhez kötve is közzétesz tematikus felhívásokat. A vállalkozások és kutatóhelyek együttműködését ösztönző Nemzeti Versenyképességi és Kiválósági Program egyik kulcsfontosságú pillére a „Kiemelkedő halálozási kockázattal járó betegségek gyógyításának eredményességét lényegesen javító nemzeti program”. A program pályázati konstrukciói olyan projekteket támogatnak, amelyek népegészségügyi szempontból is jelentős betegségek hatékonyabb gyógyításához járulnak hozzá. Győrffy Balázs az NKFI Alapból finanszírozott onkológiai projektje is ilyen; a kutatómunka fókuszában a központi idegrendszeri tumorok állnak, ezek közül is a gyermekkori rosszindulatú agydaganatok leggyakrabban előforduló típusa, a medulloblastoma. A különleges, akár személyre szabott terápiás megközelítésről őt, a projekt vezetőjét, a Semmelweis Egyetem II. Sz. Gyermekgyógyászati Klinikájának tudományos tanácsadóját, egyúttal Lendület-kutatócsoport-vezetőt kérdeztük.
Azt már tudjuk, hogy nem a kifejlődött idegsejtből keletkezik a tumor – magyarázza Győrffy Balázs –, a medulloblastoma közvetlenül az idegsejt elődjéből jön létre. De vannak olyan központi idegrendszeri tumorok is, amelyek az ún. gliasejtek elődjeiből alakulnak ki (a gliasejtek az idegsejteket körbefogó, azokat megtámasztó és védő sejtek).
Amikor a betegséget diagnosztizálják, az orvosi protokoll szerint először sebészi úton eltávolítják a tumort – úgy, hogy az egészséges szöveteket a lehető legkevésbé érintsék. Ezután következik a besugárzás, amellyel az esetlegesen visszamaradt tumorsejteket pusztítják el. A harmadik lépés a kemoterápia, a gyógyszeres kezelés. A most alkalmazott szereket a hetvenes évektől a kilencvenes évekig folyamatosan vezették be, és bár jelentősen javítják a gyógyulás esélyét, több mint két évtized elteltével hatásosabbakra is szükség lenne.
A gyógyszerfejlesztéskor rendszerint abból indulnak ki, hogy egy daganatos elváltozáshoz vezető génhiba esetén azt az egységet – például az epidermális növekedési faktor receptort, röviden EGFR-t (a sejtnövekedést előidéző sejtfelszíni receptor) – kell megcélozni, amelyben a hiba előfordul. Győrffy Balázsék világszinten egyedülálló megközelítése további géneket is azonosít egy számítógépes algoritmus segítségével. Ők szintén megkeresik a „kiindulási” génhibát, de kifejezetten nem a hibás gént veszik célba, hanem olyan géneket is, amelyeknek a működését a meghibásodott gén befolyásolhatja, mert az ilyen gének megváltozott működése is felelős lehet a tumor kialakulásáért. A gyógyszeres kezelésnek tehát egyszerre több célpontot is támadnia kell.
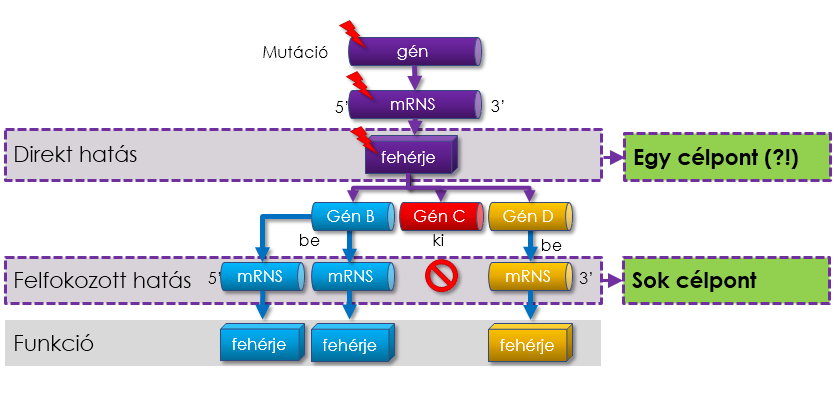 |
| A mutáció miatt meghibásodott gén további gének működését befolyásolja. Az új megközelítés szerint a gyógyszeres kezelésnek több célpontot kell támadnia. |
Az algoritmus működtetéséhez először össze kell gyűjteni az összes rendelkezésre álló adatot. A daganatos betegeket aszerint csoportosítják, hogy kimutattak-e bennük genetikai hibát, vagy sem, és milyen volt a prognózisuk. Ezután az algoritmus kikeresi azt a gént, illetve géneket, amelyek a legszorosabb összefüggést mutatják a betegség kimenetelével egy adott betegcsoportban. Ennek a génnek (illetve géneknek) a működését igyekeznek blokkolni.
A számítógépes munka a Semmelweis Egyetemen folyik. Ezután az MTA Természettudományi Kutatóközpont egyik csoportjához kerül a projekt következő fázisa, ők egy olyan szert készítenek, amelyik gátolja a kiválasztott gén működését. Ugyanitt, egy másik csoportban ellenőrzik és elemzik is ennek a molekulának a hatását. Aztán újra a Semmelweis Egyetem következik: laboratóriumi körülmények között, sejtkultúrán és állatkísérletben vizsgálják meg, hogy az előállított molekula valóban hat-e a tumorra.
- A hiba azonosítása
- A gátlószer előállítása
- Annak igazolása, hogy a gátlószer hat a genetikai hibára
- Annak igazolása, hogy a gátlószer által blokkolt hiba részt vett a tumor létrejöttében
Sarokpontok a gyógyszertervezésben
A projekt harmadik partnere a Meditop Gyógyszeripari Kft. (NKFI Alapból támogatott konzorciumi tag), amely kifejezetten a szájon át szedhető gyógyszerekre specializálódott (szemben az összes hagyományos kemoterápiás gyógyszerrel, amelyek szinte egyike sem adható szájon át). Itt készülhet el az a gátlószer, pontosabban remélhetőleg több gátlószer, amelyek tisztasága és stabilitása már megengedi, hogy akár beteg gyermekeknek is beadják őket. Az alkalmazásig azonban hosszú tesztelési folyamat vezet.
A fejlesztés maga is hosszú időt vesz igénybe: a kutatók azt tervezik, hogy a következő másfél évben meghatározzák az elmúlt tíz évben kezelt összes, központi idegrendszeri tumorban szenvedő gyermek daganatának genetikai mintázatát. A projekten körülbelül húszan dolgoznak négy vezető kutató irányításával, de a nagy volumenű munkába egyetemi hallgatókat, PhD-hallgatókat és posztdoktorokat is bevonnak.
Pálinkás József: 3,5 milliárd forinttal támogatja az állam a Nemzeti Kvantumtechnológiai Program megvalósítását
(ábrával a 2014 óta meghirdetett tematikus nemzeti kutatásfejlesztési programokról)
Konkrét eredmények és ígéretes perspektívák a hazai agykutatásokban






